7+PPI+机器学习+实验,非肿瘤结合建模筛选生物标志物,可升级
今天给同学们分享一篇生信文章“Identification of diagnostic biomarkers and therapeutic targets in peripheral immune landscape from coronary artery disease”,这篇文章发表在J Transl Med期刊上,影响因子为7.4。

结果解读:
外周血中差异mRNA表达的鉴定
本研究涉及199名冠心病患者和218名对照组的外周血转录组。PCA分析显示,批次效应在三个基因集中被有效去除(图2A,B)。共鉴定出762个差异表达基因(DEGs),其中396个基因上调,366个基因下调(图2C)。前五个上调基因分别为C17orf78、TTTY21、TMEM213、COL21A1和SNX31,而前五个下调基因包括EGR3、TTTY7、TMEM196、DNAJC28和OLR1。热图显示了冠心病患者和对照组之间|logFC|> 0.2的基因,表明它们可能参与了冠心病的病理过程(图2D)。

差异表达基因的功能富集分析
为了探索这些差异表达基因(DEGs)与调控过程中涉及的生物学功能之间的关系,作者构建了蛋白质相互作用(PPI)网络。PPI分析显示这些基因在蛋白质水平上有强连接(图3A)。GO分析显示DEGs涉及分子功能、生物过程和细胞组分等方面的特征,如受体配体活性、转运复合物和细胞过程(图3B)。KEGG通路富集图显示主要富集的通路包括细胞因子-细胞因子受体相互作用、神经活性配体-受体相互作用和IL-17信号通路,表明与炎症反应和神经活动相关的功能有强相关性(图3C)。

DE-IRGs的确定和免疫相关细胞景观分析
CAD患者中的上述DEGs与IRGs交集。确定了58个CAD患者中的DE-IRGs(图4A)。与对照组相比,这些芯片中的七种免疫细胞亚群比例发现在CAD患者中有所不同。其中,激活的树突状细胞、肥大细胞、中性粒细胞、Th17细胞和MDSC在CAD中的比例增加(P < 0.05),而激活的B细胞和CD56杀伤细胞的比例减少(P < 0.05)(图4B,C)。此外,外周免疫细胞的变化之间存在相关性(图4D),例如激活的CD4 T细胞/Th2细胞(r = 0.62),巨噬细胞/肥大细胞(r = 0.55)和中性粒细胞/浆细胞样树突状细胞(r = 0.62)。

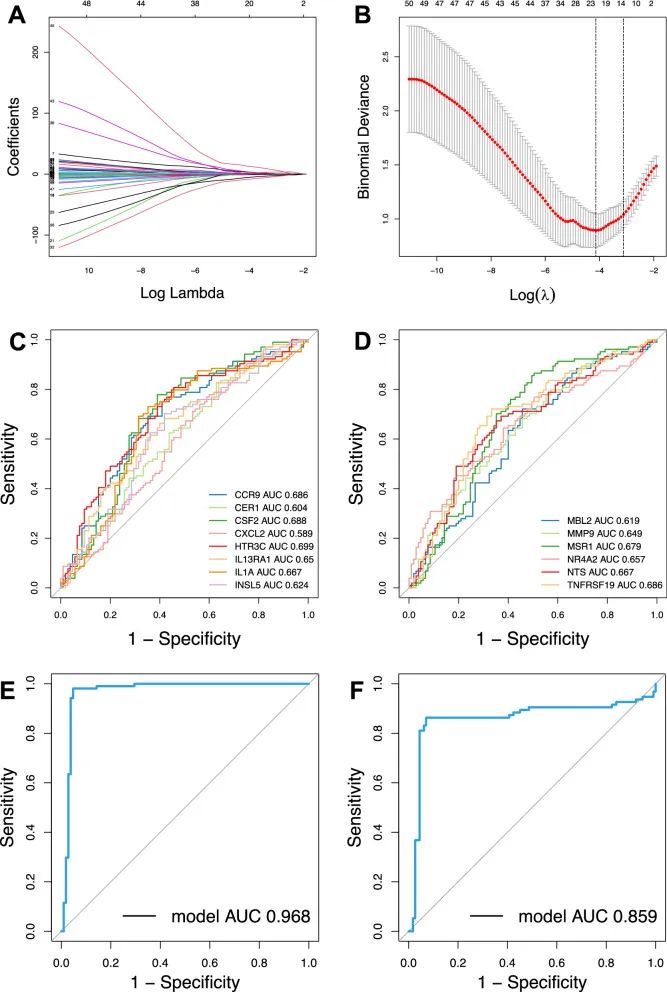
鉴定14个关键的周边CAD DE-IRGs并构建免疫诊断模型
作者通过LASSO回归减少了维度,并最终确定了14个基因来构建CAD的诊断模型(图5A,B)。通过ROC曲线评估了识别出的14个关键外周DE-IRGs的诊断性能。ROC曲线下的面积分别为CCR9(AUC = 0.686),CER1(AUC = 0.604),CSF2(AUC = 0.688),CXCL2(AUC = 0.589),HTR3C(AUC = 0.699),IL13RA1(AUC = 0.650),IL1A(AUC = 0.667),INSL5(AUC = 0.624),MBL2(AUC = 0.619),MMP9(AUC = 0.649),MSR1(AUC = 0.679),NR4RA2(AUC = 0.657),NTS(AUC = 0.667)和TNFRSF19(AUC = 0.686)(图5C,D)。然而,当所有14个基因包含在一个诊断模型中时,训练数据集和测试数据集的AUC分别达到0.968和0.859(图5E,F)。结果证明,这些组合的DE-IRGs具有良好的诊断潜力,可能也成为CAD的有希望的预防和治疗靶点。
冠心病患者的外周免疫特征分析
14个关键外周DE-IRGs在冠心病组和对照组之间显示出显著变化。其中,CCR9、CER1、CSF2、IL13RA1、INSL5、MBL2、MMP9、MSR1、NTS和TNFRSF19基因的表达上调(P < 0.05),而CXCL2、HTR3C、IL1A和NR4A2基因的表达下调(P < 0.05)(图6A)。这些基因之间显示出显著的正相关,例如CER1/NTS(r = 0.85)、CER1/IL13RA1(r = 0.79)和NTS/TNFRSF19(r = 0.94)(图6B)。考虑到多种免疫成分在冠心病诊断和病理机制中的重要作用,作者分析了免疫细胞与CAD中DE-IRGs表达之间的相互关系。例如,IL13RA1在中性粒细胞、3种类型的树突状细胞(活化、未成熟和浆细胞样)、巨噬细胞、记忆B细胞、单核细胞、自然杀伤细胞、MDSC、自然杀伤细胞、肥大细胞、2种类型的T细胞(自然杀伤和γδ)和嗜酸性粒细胞中显示出强烈的上调表达(P < 0.01),而在活化B细胞、活化CD8 T细胞和CD56dim自然杀伤细胞中显示出快速的下调表达(P < 0.01)。MMP9在中性粒细胞、3种类型的树突状细胞(活化、浆细胞样、未成熟)、单核细胞、记忆B细胞、巨噬细胞、γδT细胞和嗜酸性粒细胞中表达增加(P < 0.01),并在活化B细胞、活化CD8 T细胞、效应记忆CD4/CD8 T细胞、未成熟B细胞中表达趋势下降(P < 0.01)(图6C)。

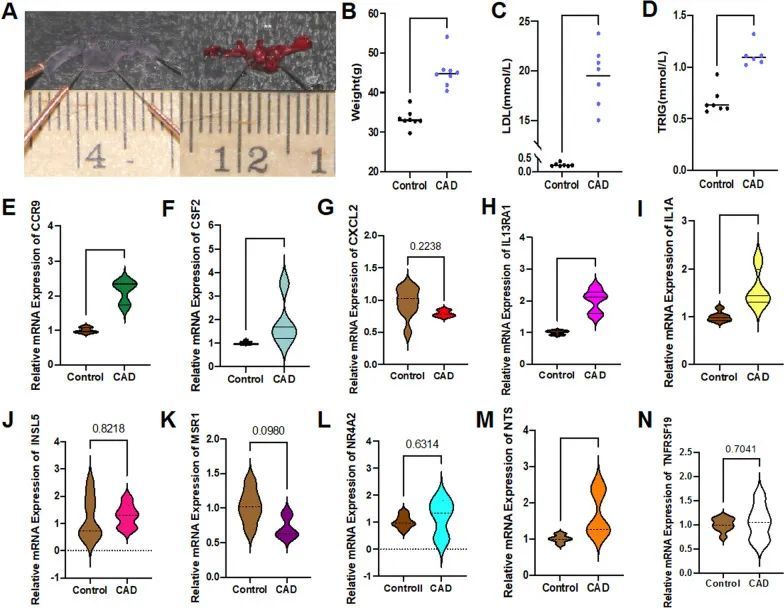
验证10个候选DE-IRGs与CAD在体内的相关性
在第20周末,病理染色(油红O)显示小鼠主动脉弓聚集了大量脂质斑块,导致管腔狭窄(图7A)。冠心病模型组的平均体重显著增加,高于对照组(P < 0.0001)(图7B)。同时,冠心病组的外周循环低密度脂蛋白(LDL)和甘油三酯(TRIG)水平显著增高(P < 0.0001)(图7C,D)。全血总mRNA检测显示,冠心病模型组的CCR9、CSF2、IL13RA1和NTS表达显著高于对照组(图7E–H,M)(P < 0.05),与在线筛选结果一致。IL1A在模型组中也有升高(P < 0.01),与在线数据结果相反(图7I)。然而,CXCL2、INSL5、MSR1、NR4A2和TNFRSF19在两组之间没有差异(P > 0.05)(图7G,J–L,N)。
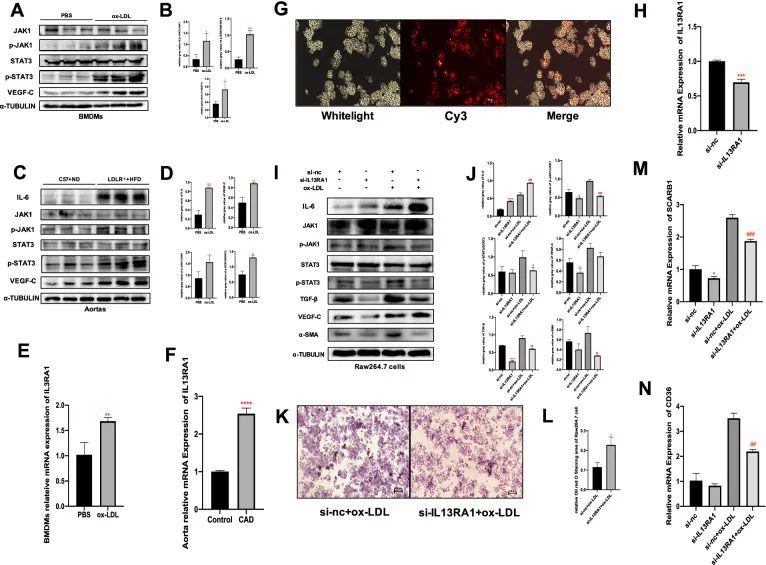
IL13RA1激活JAK1/STAT3途径并调节冠心病中巨噬细胞的功能
在体外实验中,氧化低密度脂蛋白(ox-LDL)上调了IL13RA1 mRNA的表达(P < 0.01),激活了JAK1/STAT3信号通路(P < 0.05,P < 0.01),并增加了骨髓源巨噬细胞中VEGF-C的产生(P < 0.01)(图8A,B-E)。在体内实验中,同样地,在20周高脂饮食诱导的LDL ?/? 小鼠(冠心病小鼠模型)的主动脉中,IL13RA1 mRNA的表达、磷酸化JAK1、磷酸化STAT3、VEGF-C和IL-6蛋白水平增加(P < 0.01,P < 0.001)(图8C,D-F)。将siRNA转染到RAW264.7细胞中后(图8G),IL13RA1 mRNA的表达显著下调(P < 0.001)(图8H),导致JAK1和STAT3的磷酸化水平、VEGF-C、TGF-β和α-SMA的下调(P < 0.05,P < 0.01)(图8I,J)。IL13RA1敲除组还显示出SCARB1和ox-LDL刺激的CD36 mRNA水平下降(P < 0.001,P < 0.01)(图8M,N)。有趣的是,IL13RA1敲除增加了IL-6的产生(P < 0.0001)(图8I,J)。在ox-LDL的刺激下,上述变化趋势保持一致且更加明显。Oil red O染色结果显示,IL13RA1敲除组巨噬细胞中吸收的脂滴减少(P < 0.05)(图8K,L)。
总结
本研究的一个目标是为在线筛选的CAD样本中的DE IRG的翻译研究提供一个简单的案例。然而,这项研究仍然是初步的,有局限性。大型临床试验和单细胞水平的研究将极大地优化目前的工作,这是作者未来的方向。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:veading@qq.com进行投诉反馈,一经查实,立即删除!