肝星状细胞中的自分泌信号回路是晚期纤维化的基础
今天给同学们分享一篇实验文章“An autocrine signaling circuit in hepatic stellate cells underlies advanced fibrosis in nonalcoholic steatohepatitis”,这篇文章发表在Sci Transl Med期刊上,影响因子为17.1。

结果解读:
单核RNA测序揭示了NASH患者中星状细胞的自分泌信号网络
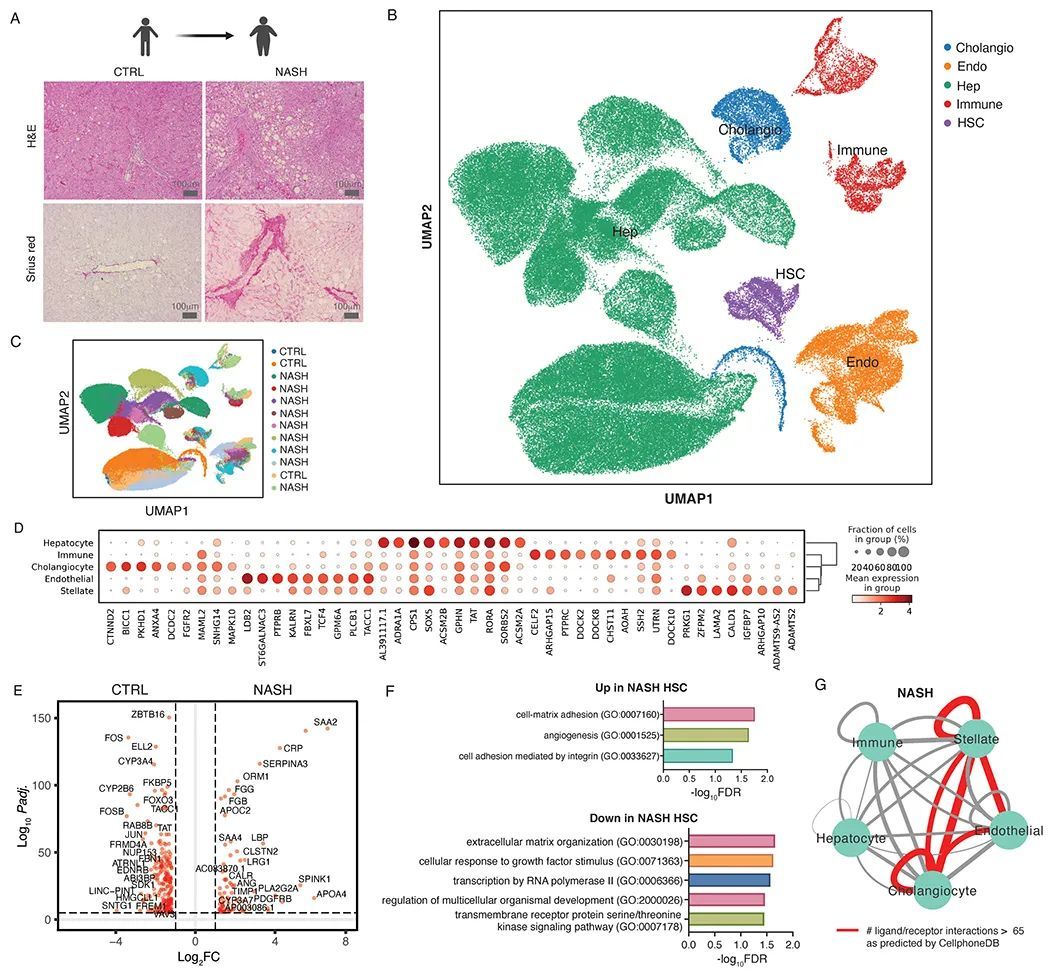
作者对来自3个对照组(肝转移切除术中的非肿瘤组织)和9个NASH患者的冷冻肝脏样本进行了snRNA-seq,该方法比之前报道的单细胞RNA-seq更有效地捕获了肝细胞和HSC的RNA表达(11)。人类对照组和NASH肝脏的苏木精和伊红染色显示,NASH中存在脂肪变性和纤维化,而对照组中不存在(图1A)。为了确保可重复性,作者分析了来自3个不同来源的人类组织,获得了128851个总核和3783个经过质控的HSC核的snRNA-seq数据,这是迄今为止最大的人类HSC转录组合集。通过信息合并这些样本的数据集,并使用基于UMAP(Uniform Manifold Approximation and Projection)的方法进行聚类,基于细胞特异性标记基因,在对照组和疾病样本中追踪了所有主要细胞类型的基因表达,比例符合预期(图1B-D)。尽管在NASH中没有出现新的细胞类型(图1C),来自NASH患者的HSCs,被称为“NASH相关HSCs”,与来自对照患者的HSCs相比,表达了一个改变的转录组谱,其中169个基因显著上调,291个基因显著下调(图1E,P < 0.05)。NASH相关HSCs中富集程度最高的通路包括细胞-基质粘附和整合素信号传导,这是预期的(图1F)。值得注意的是,属于“细胞外基质组织”类别的几个基因被下调,支持HSCs不仅作为细胞外基质成分的分泌者,还作为整体细胞外基质重塑的关键贡献者。使用CellphoneDB软件预测NASH肝中的细胞间相互作用揭示了一个由HSCs、胆管上皮细胞、内皮细胞及其自分泌相互作用组成的三方细胞间通讯网络(图1G,)。这些结果进一步证实了最近的观察结果,强调了HSCs作为肝病细胞间通讯中枢的作用(19),并进一步建立了数学模型预测的肝纤维化下的肌成纤维细胞自分泌信号传导回路的体内证据(8, 9)。
星状细胞自分泌信号在FAT-NASH小鼠中保持不变
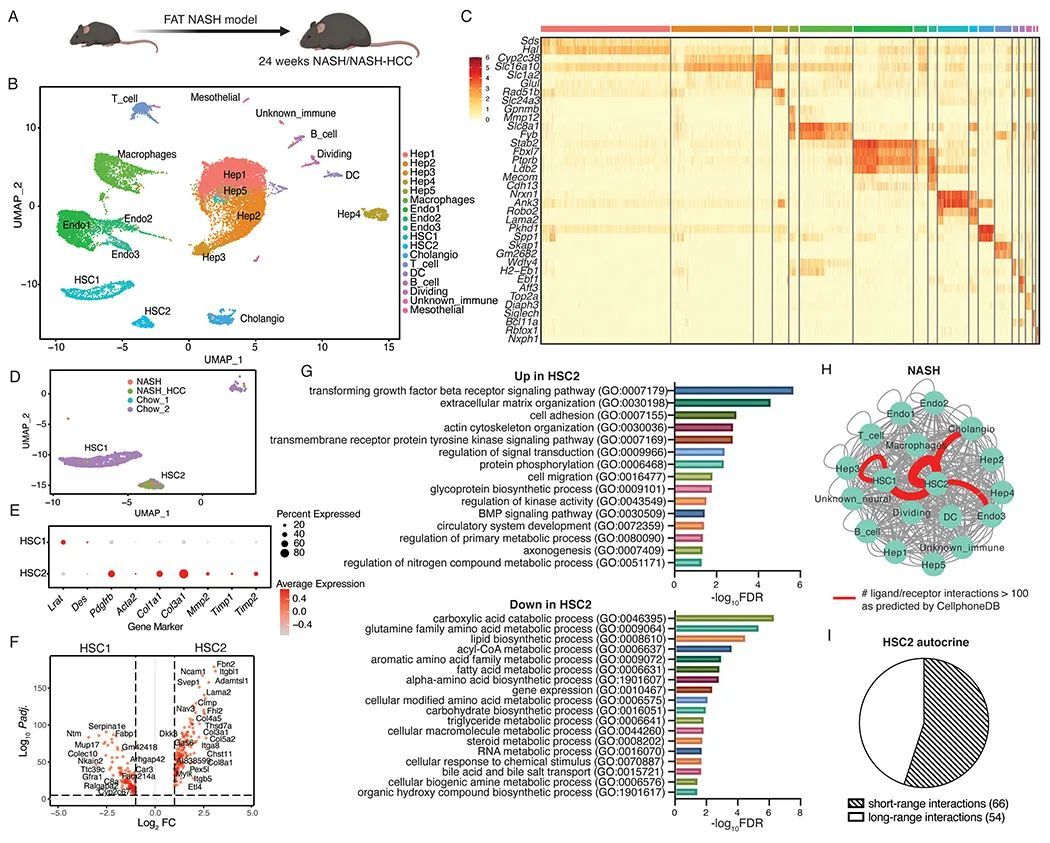
接下来,作者测试了FAT-NASH小鼠NASH模型是否忠实地重现了人类NASH中发现的细胞间通讯网络(12, 13)。为此,作者使用snRNA-seq对对照组和24周FAT-NASH小鼠的HSC转录组进行了分析(图2A)。从对照组和24周FAT-NASH小鼠中各选取了三个肝脏,将其混合成一个样本,并使用Seurat-LIGER算法在质控后将数据进行了信息合并,生成了一个包含19249个核的UMAP图(图2B)。在使用小鼠的经典标记基因对不同核团进行了注释后,作者恢复了所有已知的肝细胞类型,并且它们的比例与现有文献中的预期相符(图2C(11))。从作者的数据中可以明显看出两个不同的HSC群体(1250个核经过质控后),分别被称为'HSC1'和'HSC2'。HSC1主要由来自对照组小鼠的核组成,并且表达了HSC静止状态的经典标记基因,包括Lrat和Des,而HSC2主要由来自FAT-NASH小鼠的核组成,并且表达了激活标记基因,如Pdgfrb、Acta2、Col1a1、Col3a1、Mmp2、Timp1和Timp2(图 2D,E),E),代表与NASH相关的HSC。差异基因表达分析显示,在HSC2中有996个显著上调的基因,包括细胞粘附和整合素信号通路,这些通路在NASH患者中存在,还包括TGFβ信号通路、肌动蛋白骨架重塑和细胞迁移等已知的纤维化驱动通路(图2F,G,P < 0.05)。与人类NASH一样,对FAT-NASH小鼠的CellphoneDB分析确定了HSC中突出的自分泌信号回路,HSC2细胞具有最多的预测配体-受体相互作用,其次是HSC2与胆管细胞之间的相互作用,然后是HSC2与一部分内皮细胞之间的相互作用(图2H)。值得注意的是,超过一半的120个HSC2自分泌配体-受体对涉及到短程相互作用(定义为非分泌或胶原/整合素相互作用),这些相互作用需要配体和其受体之间的细胞-细胞接近(图2I),突显了在晚期纤维化中激活的HSC中出现的自分泌回路。
肝星状细胞与细胞之间的接触在FAT-NASH小鼠的肝脏中逐渐增加
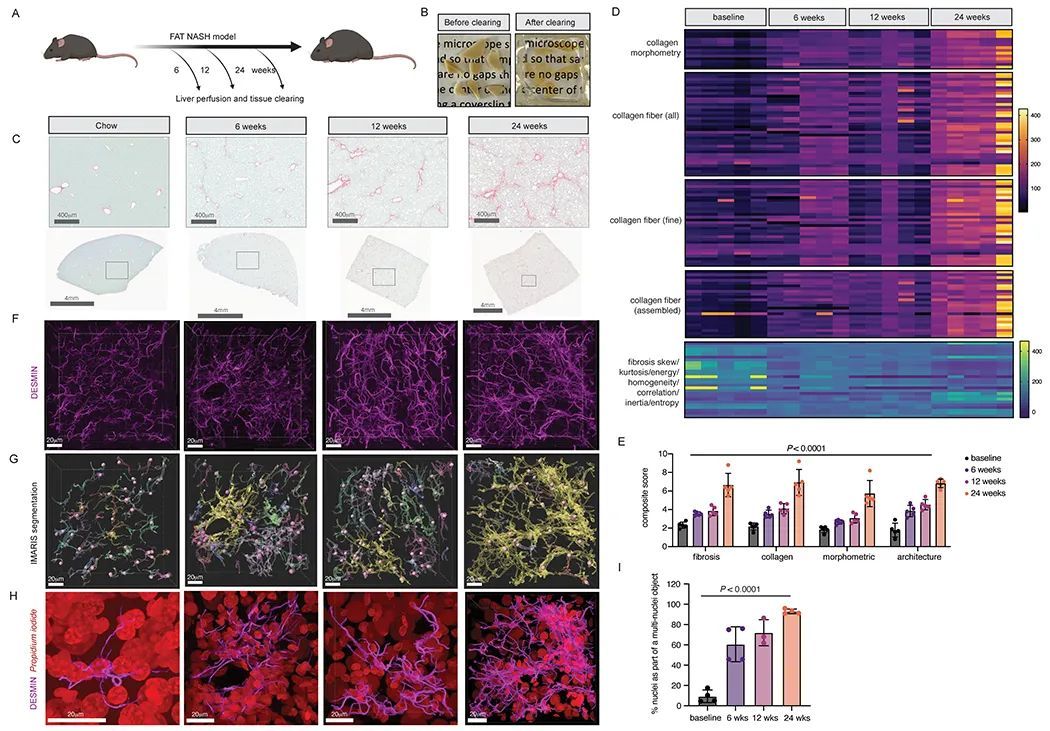
在休息的肝脏中,HSCs定位于Disse间隙,位于肝细胞和内皮细胞之间。为了澄清HSCs在这个解剖环境中如何相互作用,建立了一种用于iDISCO组织清理(18)和共聚焦成像的流程,以使用针对小鼠肝脏中HSCs的标记物DESMIN染色生成高分辨率的2D图像(图3A,B)。然后,使用IMARIS软件对图像堆栈进行3D重建和分割(图3F,G)。这些高分辨率的3D重建图像能够可视化详细的HSC形态,包括其细胞投射,其形状与神经元非常相似。IMARIS将单个HSCs(在图3G中用不同的伪彩色表示)分类为单独的DESMIN+表面物体,这些物体覆盖了由丙碘胺标记的单个细胞核(在图3G中由粉色球体建模)以可视化核DNA(图3G)。在饲喂饲料的健康小鼠的肝脏中,HSCs呈均匀排列。
HSC自分泌信号因子NTRK3是NASH中的抗纤维化药物靶点
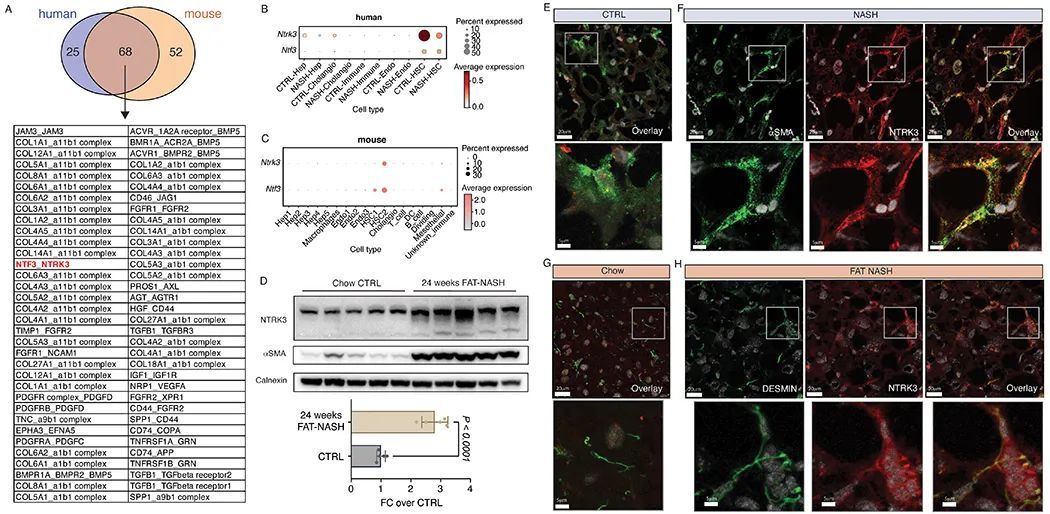
作者的数据表明,在NASH中,HSCs创建了一个与snRNA-seq预测的自分泌信号增加相似的物理相互作用网络。为了证明HSC自分泌信号可能通过HSC的物理相互作用在FAT-NASH模型中介导,作者试图在体内定位一个特定的自分泌受体NTRK3到HSC的突出部分。作者将在NASH和FAT-NASH小鼠以及人类患者中鉴定出的自分泌相互作用与交集,得到了68个在两个物种中都保留的自分泌受体-配体对(图4A)。在这些候选的受体-配体对中,作者关注了NTRK3-NTF3,因为这条通路在HSCs中尚未被描述。对作者的snRNA-seq数据集的分析确认了NTRK3和其预测的配体NTF3在患者和小鼠的HSCs中的选择性表达(图4B, C)。在NASH中,NTRK3和NTF3基因的表达在小鼠和患者之间存在差异,但在FAT-NASH小鼠中,这两个基因都增加了,与饲料对照组相比。在NASH患者中,与对照患者相比,NTRK3的表达减少。使用整个肝脏的裂解物,作者发现NTRK3蛋白存在于小鼠的肝脏中,并在NASH中强烈诱导(图中)。4D),但在人类肝脏中未检测到,可能是因为其他细胞类型的信号被稀释了。这些物种差异可能反映了人类样本的固有异质性,其中患者的年龄、性别和背景各不相同,而小鼠则是近交并且在分析之前都接受了相同的条件。因此,作者认为NTRK3表达在NASH中可能会增加,但需要在更加标准化的患者队列中进行进一步验证。更重要的是,NTRK3蛋白在NASH中通过免疫荧光定位到HSC投射物中,这些投射物在人类中与HSC特异性标记物αSMA(图4E-F)和小鼠中的DESMIN(图4G-H)交集可见。这些重要发现加强了作者提出的模型,即在NASH中,HSC通过扩展的物理自分泌接触增加了“有效信号传递”。
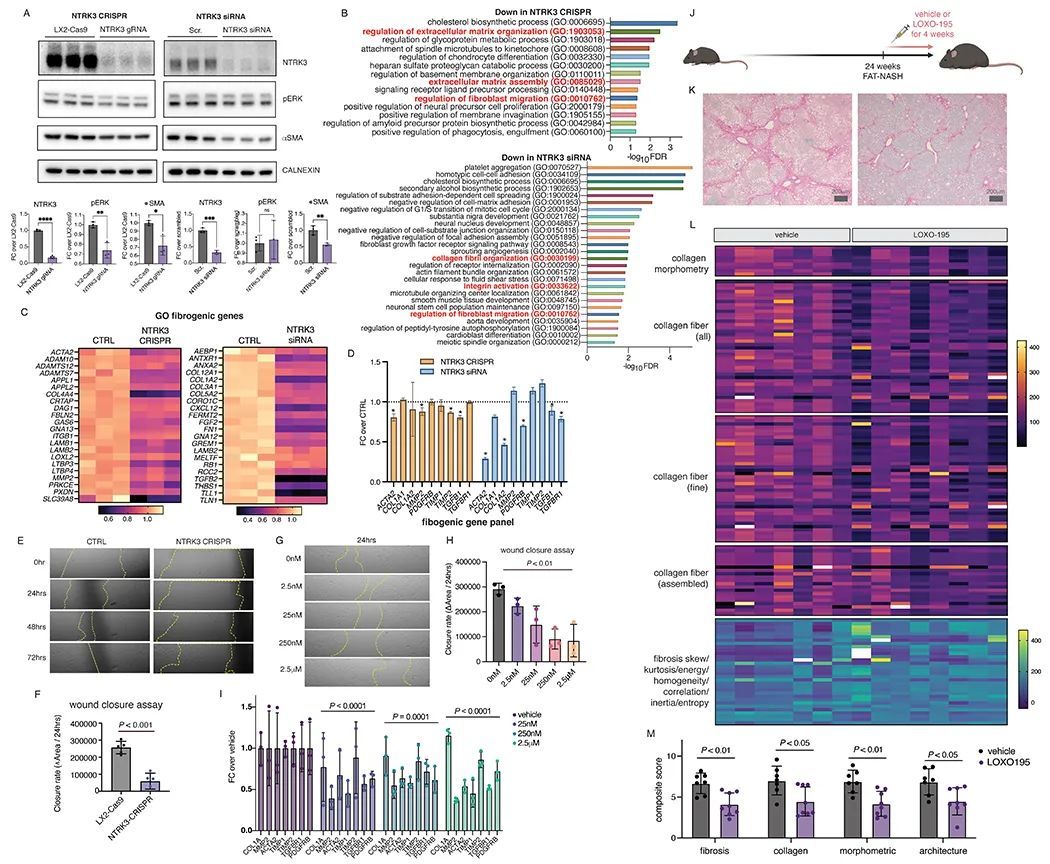
为了将HSC NTRK3-NTF3自分泌信号作为NASH纤维化的驱动因素,使用CRISPR-Cas9和siRNA在人类星状细胞系LX-2中敲除了NTRK3。CRISPR稳定敲除NTRK3通过Western blot减少了ERK磷酸化和αSMA表达,而siRNA短暂敲除NTRK3仅减少了αSMA表达(图5A)。对NTRK3 CRISPR和NTRK3 siRNA处理的LX-2进行无偏倚的RNAseq分析,发现了纤维化途径的减少,包括“细胞外基质组织的调节”、“细胞外基质组装”、“胶原纤维组织”、“整合素激活”和“成纤维细胞迁移的调节”(图5B),这些途径中的基因显示在图5C中。作者还在批量RNA-seq数据集中检测了一系列已知的纤维化基因,结果显示NTRK3 CRISPR和NTRK3 siRNA处理的LX-2细胞总体上减少了这些基因的表达(图5D)。与RNAseq分析一致,敲除NTRK3抑制了LX-2细胞的迁移,这通过创伤闭合实验得到了证实(图5E, F)。同时,使用LOXO-195在LX-2细胞中药物学上也阻断了NTRK3的活性。LOXO-195是一种第二代高度特异性的NTRK3激酶结构域抑制剂,目前正在临床试验中用于治疗TRK融合阳性癌症。与CRISPR-Cas9基因敲除相似,LOXO-195在纳摩尔浓度下对LX-2细胞的迁移表现出剂量依赖性的抑制作用(图5G,H),而不影响细胞的存活或增殖。与迁移减少同时,LOXO-195处理降低了LX-2的纤维化能力,通过与车辆对照相比,表现出较低的一组已建立的纤维化基因的表达(图5I)。
总结
在这项研究中,作者利用了snRNA-seq的最新技术进展来捕获HSC单细胞转录组,结合小鼠模型的组织清除技术,实现了高分辨率的三维组织成像。利用这种策略,作者揭示了在进展期NASH纤维化中支持HSC激活的细胞间联系显著增强的自分泌信号回路。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:veading@qq.com进行投诉反馈,一经查实,立即删除!