文献速递:PET-影像组学专题--PET衍生的影像组学和人工智能在乳腺癌中的应用:一篇系统综述
文献速递:PET-影像组学专题–PET衍生的影像组学和人工智能在乳腺癌中的应用:一篇系统综述
01
文献速递介绍
乳腺癌(BC)是目前流行度最高的恶性肿瘤,也是全球女性癌症相关死亡的第二大原因,过去十年间发病率持续增加[1]。乳腺癌在表达多种不同受体和基因突变方面表现出异质性。特别是,受体状态将乳腺癌分类为四个类别,即Luminal A、Luminal B、人表皮生长因子受体2(HER-2)阳性和三阴性乳腺癌(TNBC),这也影响了治疗选择和生存预测[2,3]。然而,肿瘤生物学特征的鉴定依赖于侵入性程序,如单个病变的活检取样,这可能并不一定能代表整个肿瘤的异质性[4,5]。通过[18F]F-氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(FDG PET/CT)的混合影像技术结合了代谢和形态特征
目前,FDG PET/CT广泛用于诊断、分期、治疗反应评估和多种恶性肿瘤(包括BC)的生存预测[6–8]。实际上,葡萄糖代谢反映了恶性细胞的生物学特性,一些研究发现代谢参数,如最大标准摄取值(SUVmax)、平均标准摄取值(SUVmean)、代谢肿瘤体积(MTV)和总病灶糖代谢(TLG),与激素受体状态和分子亚型相关[9–12]。
然而,从FDG PET/CT图像中得出的半定量参数也有自身的缺点;例如,SUVmax仅代表单个最热的像素,而MTV依赖于基于阈值的方法,因此无法完全捕捉BC的异质性[13]。
在日益个性化的医学背景下,识别可靠且非侵入性的生物标志物,以预测肿瘤的异质性,对患者的治疗至关重要。影像组学,定义为识别图像像素中隐藏的、人眼通常无法直接观察到的可挖掘变量的过程,目前是医学影像分析领域的新兴技术。影像组学包括从医学图像中高通量提取大量定量参数,无论是自动还是非自动的,基于这样的假设:所提取的特征可能与肿瘤病变的基因型和分子特征相关。影像组学的非侵入性质和研究及随时间跟踪所有病变分布的可能性,避免了重复活检的需求,这些无疑是放射组学的优势[14–16]。
在BC的背景下,影像组学数据来自使用不同医学影像(如超声、乳房X光摄影、磁共振成像(MRI)和PET/CT)进行的多项研究[17–20]。
人工智能(AI)是计算机科学的一个分支[21],包括机器学习(ML)和深度学习(DL)[22]。ML模型基于最初提供的训练数据集来发展其回答未来问题的逻辑。DL是ML的最新类别,已被发现比其他形式的ML有优势[23]。计算机科学算法、工具和与医学影像相关的应用程序在过去几年中迅速增加[24,25]。Aktolun在2019年描述了影像组学和AI在核医学中的潜力和挑战[26]。
我们系统综述的目的是总结PET放射组学在BC中的当前作用,并描述其在临床实践中的潜在应用,以协助医生改善患者管理。
Title
题目
PET-Derived Radiomics and Artificial Intelligence in BreastCancer: A Systematic ReviewPET
衍生的影像组学和人工智能在乳腺癌中的应用:一篇系统综述"
Abstract
摘要
Breast cancer (BC) is a heterogeneous malignancy that still represents the second cause of cancer-related death among women worldwide. Due to the heterogeneity of BC, the correct identification of valuable biomarkers able to predict tumor biology and the best treatment approaches are still far from clear. Although molecular imaging with positron emission tomography/computed
tomography (PET/CT) has improved the characterization of BC, these methods are not free fromdrawbacks. In recent years, radiomics and artificial intelligence (AI) have been playing an importantrole in the detection of several features normally unseen by the human eye in medical images. Thepresent review provides a summary of the current status of radiomics and AI in different clinicalsettings of BC. A systematic search of PubMed, Web of Science and Scopus was conducted, includingall articles published in English that explored radiomics and AI analyses of PET/CT images inBC. Several studies have demonstrated the potential role of such new features for the staging and
prognosis as well as the assessment of biological characteristics. Radiomics and AI features appear to be promising in different clinical settings of BC, although larger prospective trials are needed to6**confirm and to standardize this evidence.
乳腺癌(BC)是一种异质性恶性肿瘤,仍然是全球女性癌症相关死亡的第二大原因。由于乳腺癌的异质性,正确识别能够预测肿瘤生物学特性和最佳治疗方法的有价值生物标志物仍然不明确。尽管正电子发射断层扫描/计算机断层扫描(PET/CT)的分子影像技术改进了乳腺癌的特征描述,但这些方法并非没有缺点。近年来,影像组学和人工智能(AI)在检测医学影像中人眼通常看不见的多个特征方面发挥着重要作用。本综述提供了放射组学和AI在乳腺癌不同临床环境中当前状态的总结。通过系统地搜索PubMed、Web of Science和Scopus数据库,包括了所有用英语发表的探索乳腺癌PET/CT影像中影像组学和AI分析的文章。多项研究已经证明了这些新特征在分期、预后以及生物特性评估方面的潜在作用。影像组学和AI特征在乳腺癌的不同临床环境中似乎很有前景,尽管需要更大规模的前瞻性试验来确认并标准化这些证据。
Methods
方法
我们在最相关的数据库和在线资源(Pubmed/Medline、Web of Science、Scopus)上进行了搜索,使用以下查询字符串:“(PET 或 正电子发射断层扫描 或 PET/CT 或 PET/MRI) 与 (乳房 或 乳腺癌) 与 (影像组学 或 纹理 或 纹理分析 或 机器学习 或 深度学习 或 人工智能 或 AI) 非综述”。考虑了2022年6月15日前发表的英语原创文章 三位作者(L.U.;L.M.;和A.C.)独立审阅了标题和摘要,以评估研究的纳入情况。当摘要被认为相关时,检索了完整文章。选择过程中应用的纳入标准如下:(a) 与乳腺癌相关的文章;及 (b) 从PET/CT、PET/MRI和/或计算机科学应用中获得的纹理分析文章。以下论文被认为不符合资格:(a) 综述文章;(b) 非英语文章;及 ? 不在关注领域内的研究(即,非影像组学/AI目标、非PET图像、会议论文、非人类研究、非乳腺癌)。数据在一个数据库中进行了总结,包括以下字段:第一作者、期刊、年份、标题、排除/问题、成像方式、计算机科学领域、患者数量、训练集大小、测试集大小、验证集大小,以及研究的设置/目的(诊断和生物学特征鉴定、新辅助化疗、分期和复查、预后、dbPET和技术论文),以供后续数据分析之用。对于每项研究,影像组学分析基于影像组学质量评分(RQS)[16]进行评估。为了做出稳健的计算,RQS由两位作者(L.U.和L.M.)盲目计算,讨论分歧以达成共识。
Results
结果
The literature search identified a total of 239 studies, reduced to 81 after excluding
duplicates, non-original articles, and papers relevant to other topics. The number ofstudies that met the inclusion criteria was 53. Figure 1 illustrates the PRISMA flowchart
of the articles included in our systematic review. Among these, 43 (81.1%) studies were
retrospective and 10 (18.9%) prospective. Radiomic data were extracted from PET/CT in 43
(81.1%) papers, PET/MRI in 4 (7.6%) and dedicated breast PET (dbPET) in 6 (11.3%) papers.
The majority of the studies were performed using [18F]-fluorodeoxyglusoce ([18F]-FDG)
(50 studies, 94.3%), but few experiences were reported using [18F]F-Fluorestradiol (18F-FES,
1 study, 1.9%) and [18F]F-Fluorothymidine (18F-FLT, 2 studies, 3.8%).
The papers were divided into six categories according to the clinical context explored and/or the type of study: diagnosis and biological characterization, neoadjuvantchemotherapy (NAC), staging and restaging, prognosis, dbPET, and technical papers.
The number of papers included in each category is shown in Table 1. Some papers were included in more than one category, based on the discussed aim.Overall, 47 out of 53 papers (88.7%) performed texture analysis, using several software packages, mostly open source (n = 26; 49.1%). Data mining was performed in 24 papers(45.3%) using ML and DL in 18 and 6 cases, respectively. In 20 out of 24 (83.3%) studiesperforming data mining, validation was also performed.
文献搜索共识别出239项研究,排除重复项、非原创文章和与其他主题相关的论文后,减少至81项。符合纳入标准的研究共有53项。图1展示了我们系统综述中包含的文章的PRISMA流程图。在这些研究中,43项(81.1%)为回顾性研究,10项(18.9%)为前瞻性研究。43篇(81.1%)论文从PET/CT中提取放射组学数据,4篇(7.6%)从PET/MRI中提取,6篇(11.3%)从专用乳腺PET(dbPET)中提取。大多数研究使用[18F]-氟脱氧葡萄糖([18F]-FDG)进行(50项研究,94.3%),但也有少量使用[18F]F-氟雌二醇(18F-FES,1项研究,1.9%)和[18F]F-氟胸苷(18F-FLT,2项研究,3.8%)的报道。这些论文根据探讨的临床背景和/或研究类型分为六个类别:诊断和生物学特征鉴定、新辅助化疗(NAC)、分期和复查、预后、dbPET和技术论文。每个类别包含的论文数量见表1。一些论文根据讨论的目标被纳入一个以上的类别。总体来看,53篇论文中有47篇(88.7%)进行了纹理分析,使用了多种软件包,大多为开源软件(n=26;49.1%)。24篇论文(45.3%)进行了数据挖掘,分别使用机器学习(ML)和深度学习(DL)的有18例和6例。在进行数据挖掘的24项研究中,有20项(83.3%)同时进行了验证。
Conclusions
结论
这篇系统综述为影像组学特征和人工智能在FDG PET乳腺癌应用提供了最新的画面。由于乳腺癌的高发病率,它是一种高影响力的肿瘤。因此,在这种恶性肿瘤上应用影像组学和人工智能在精准医学、患者管理和预后方面具有非常高的相关性。然而,尽管过去五年进行了大量工作,但在这些方法能够在日常临床实践中实施之前,还需要进一步的研究。在表征原发性肿瘤特征方面,特别是分子亚型方面,已经取得了有希望的结果,尽管并非所有分析的研究都证实了这一点。如果在更大规模的研究中得到验证,或甚至通过使用大数据,影像组学可以提供一个额外的工具,与乳腺活检所提供的内容并行,进一步探索乳腺癌特征。在这个背景下,比较dbPET和wbPET的论文表明dbPET衍生的放射组学特征更为优越。然而,dbPET并不允许探索远处可能的转移。
迄今为止,PET影像组学在乳腺癌预后分层方面的应用效果令人失望,特别是定量参数,尤其是代谢肿瘤体积(MTV),似乎仍然是此目的最可靠的指标[9]。目前,PET影像组学在乳腺癌应用最有趣的场景似乎是评估腋窝淋巴结(ALN)状态和预测新辅助化疗(NAC)后病理完全缓解(pCR)。早期识别ALN转移对乳腺癌患者的预后以及选择手术程序的侵袭性(SLNB vs. ALND)有重大影响[102]。同样,识别出NAC后无法达到pCR的患者,对于提供第二线疗法至关重要[86]。然而,PET影像组学研究仍然非常不均一,并且缺乏日常临床实践所需的可重复性,这已被之前的分析所暗示[20,81,103]。在这个背景下,考虑到表2和表3中的概览,已经开始了初步的标准化趋势。表格上半部分的最新研究至少报告了用于放射组学分析的主要方法信息,而表格底部的旧研究则缺乏方法学数据。
这可能被视为使用稳固、公认的影像组学分析系统的第一步,我们希望这将允许在不久的将来广泛使用AI进行选定的应用。
Figure
图
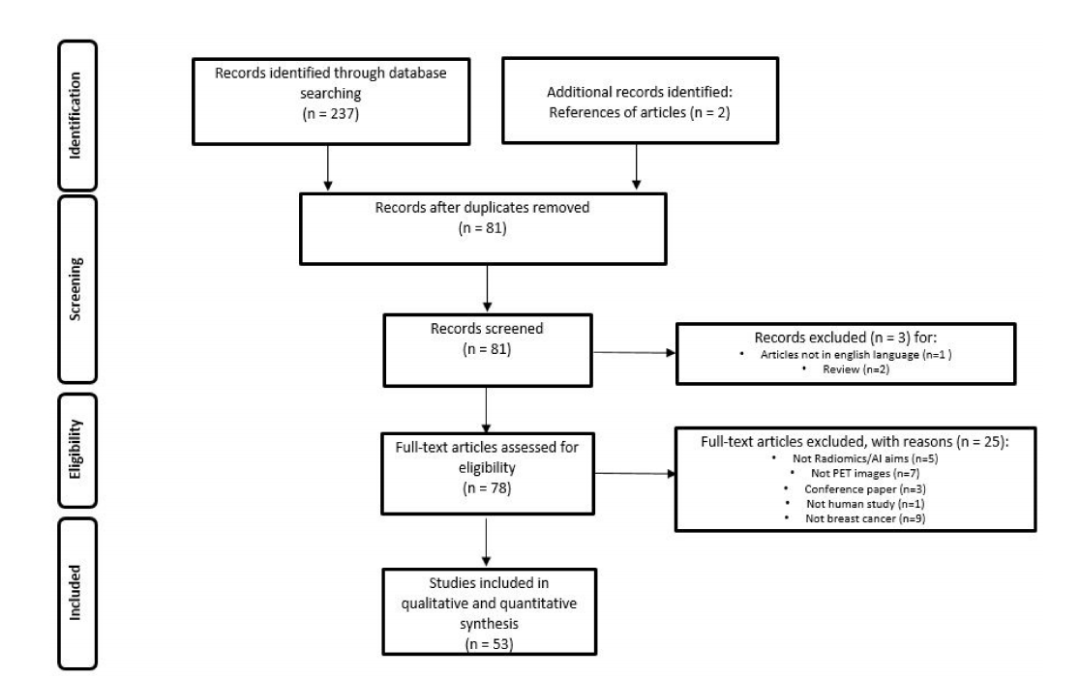
Figure 1. PRISMA Flowchart of study selection and inclusion in the systematic review.
图1. PRISMA流程图,展示了系统综述中研究选择和纳入的流程
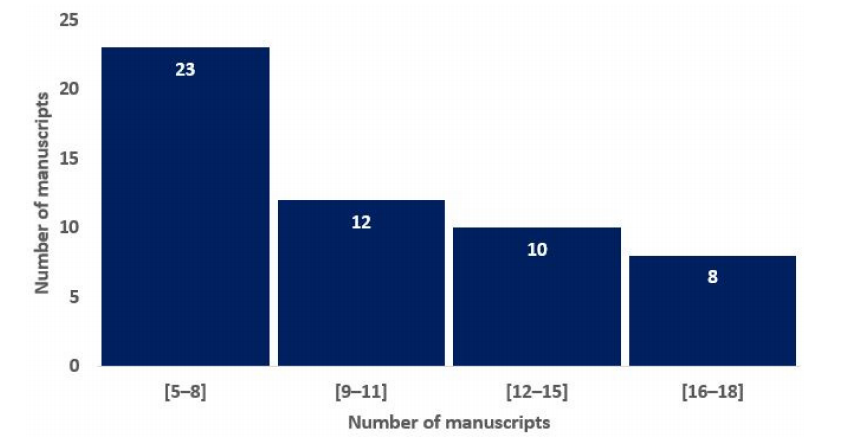
Figure 2. Histograms of average RQS scores according to the blinded analysis of two authors, basedon the previous study of Lambin and colleagues [16].
图2. 根据Lambin及其同事的先前研究[16],基于两位作者盲审的平均RQS分数的直方图。
Table
表
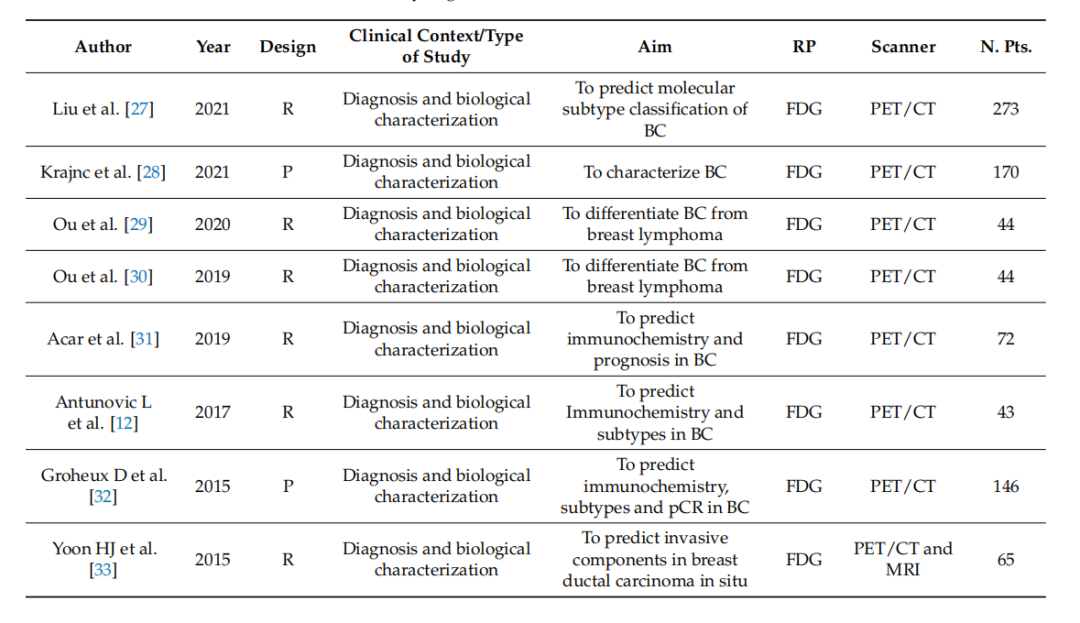
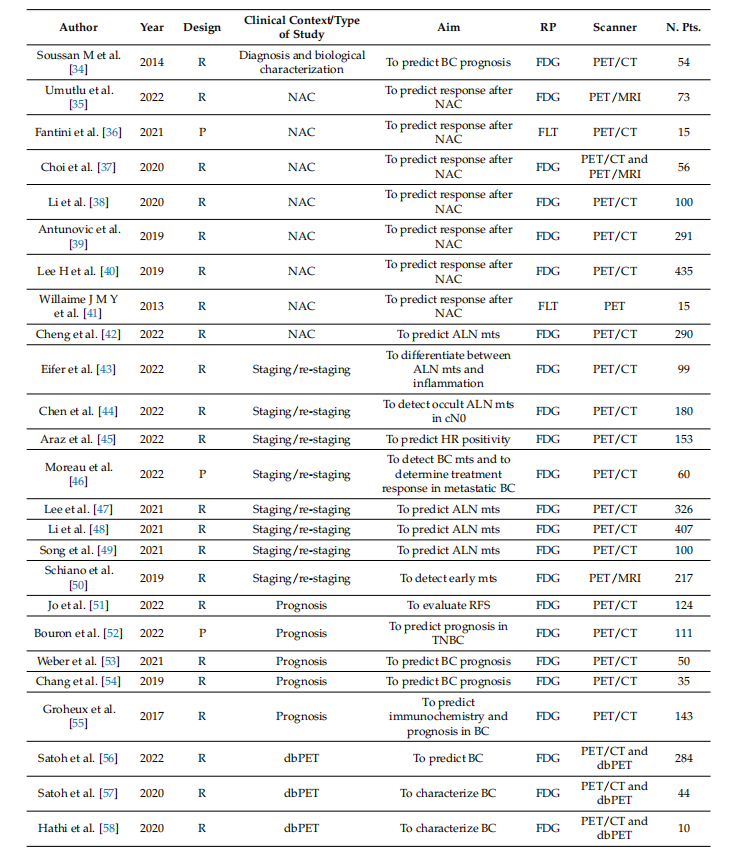
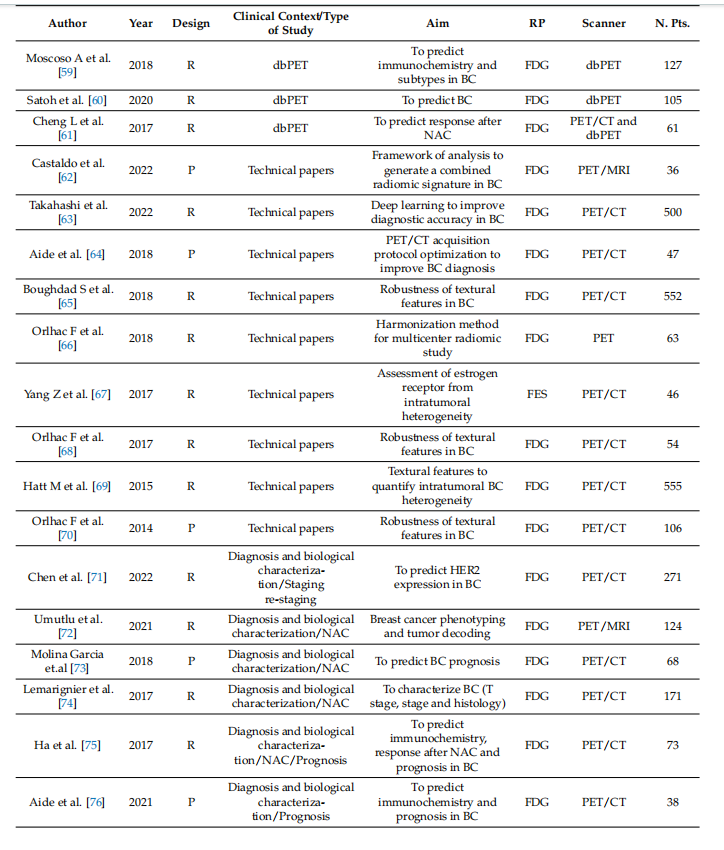
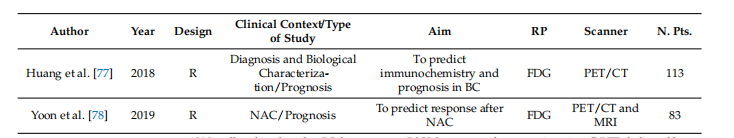
Table 1. Summary of general characteristics of studies.
表1. 研究的一般特征总结。
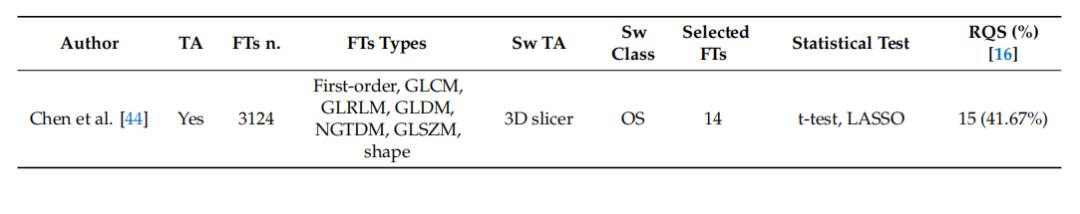
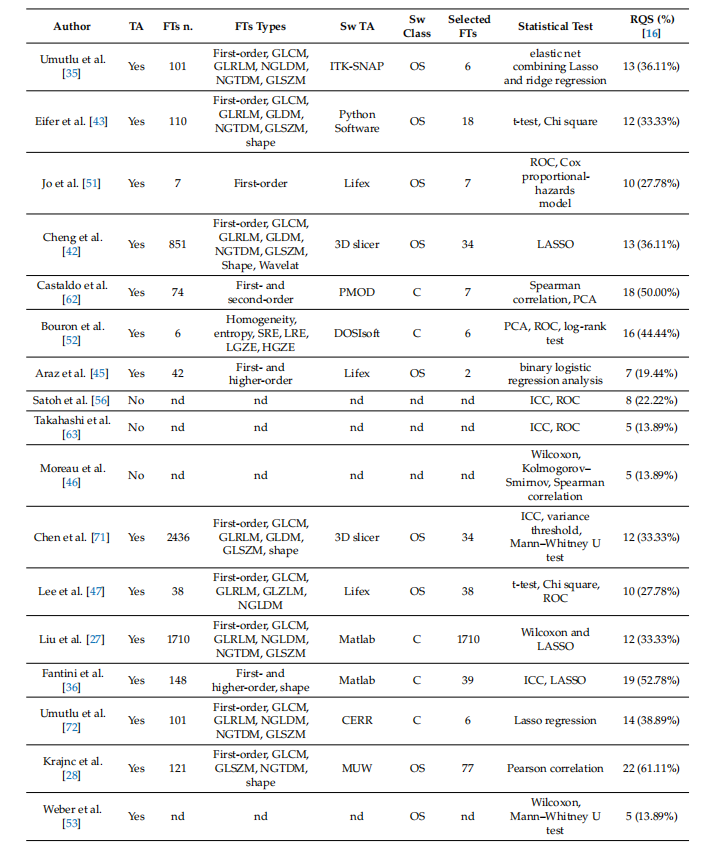
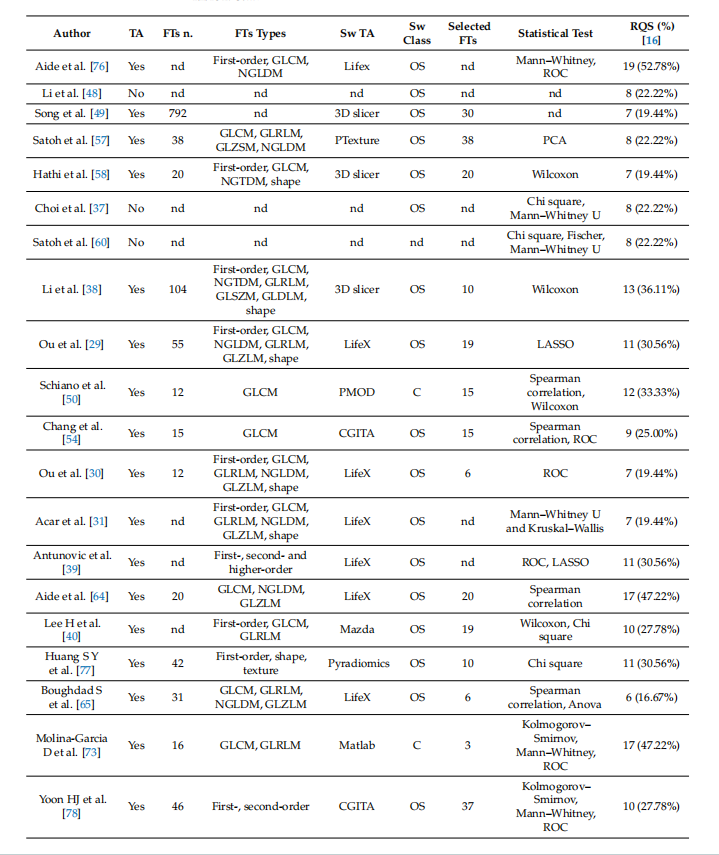
Table 2. Summary of studies’ radiomic features analyses (from newest to older).
表2. 研究影像组学特征分析的总结(从最新到较旧)。
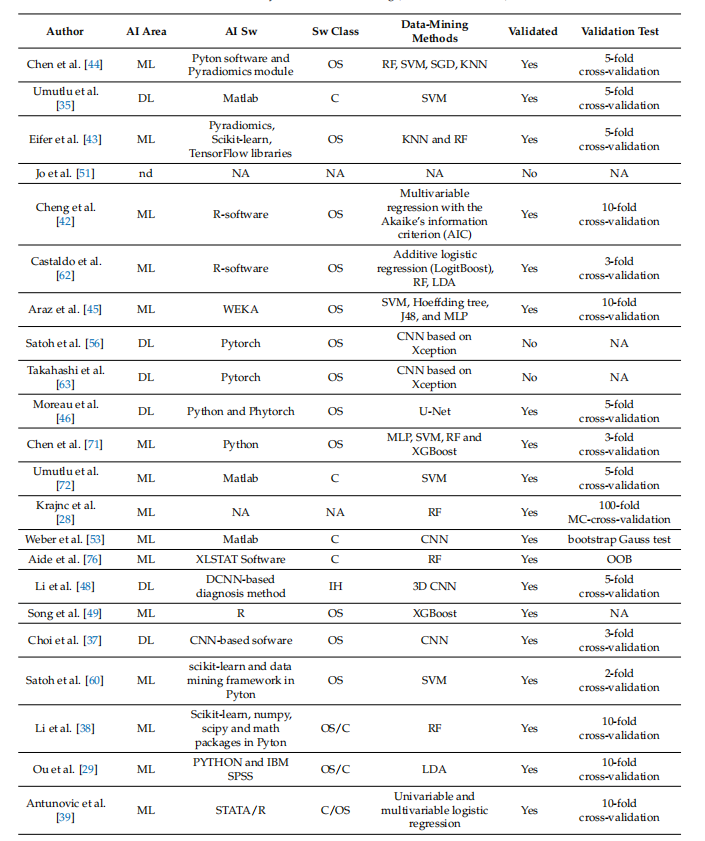
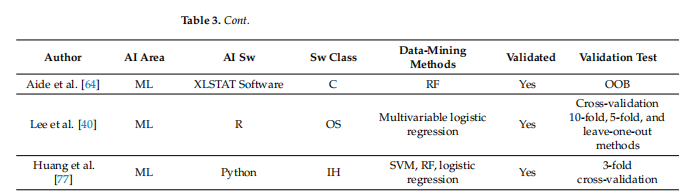
Table 3. Summary of studies’ data mining (from newest to older)
表3. 研究数据挖掘的总结(从最新到较旧)
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:veading@qq.com进行投诉反馈,一经查实,立即删除!