新颖度爆表。网络药理学+PPI+分子对接+实验验证
今天给同学们分享一篇生信文章“The convergent application of metabolites from Avena sativa and gut microbiota to ameliorate non-alcoholic fatty liver disease: a network pharmacology study”,这篇文章发表在J Transl Med期刊上,影响因子为7.4。

结果解读:
AS的次生代谢物(SMs)及其靶点
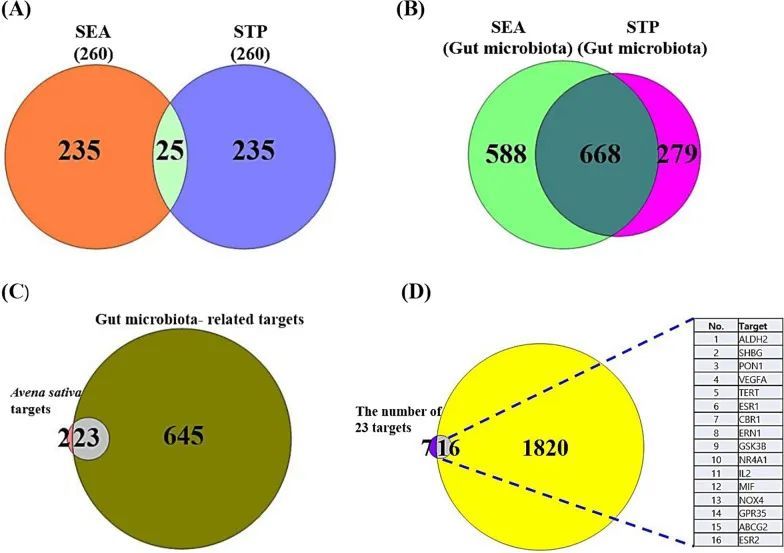
从NPASS数据库中记录了12个SMs的数量,所有这些SMs都符合Lipinski的规则(表2)。通过SEA(260)和STP(260)检索到与这12个SMs相关的靶点,因此,在化学信息学数据库之间确定了25个交集的靶点(图2A)。这25个交集的靶点被认为是与AS相关的重要蛋白编码基因。
GM的次生代谢物(SMs)
作者在gutMGene数据库中确定了208个SMs(附加文件1:表S1),与这208个SMs相关的目标通过SEA(1256个)和STP(947个)得到了确认(附加文件1:表S1)。交集的668个目标被视为与GM中的SMs相关的重要蛋白编码基因(附加文件1:表S1)(图2B)。
AS相关目标和GM相关目标之间的交集目标
在AS和GM之间,从25个交集的AS目标和668个GM目标中确定了23个目标的数量,表明这23个目标对于在AS和GM上发挥组合疗效具有重要意义(图2C)。
非酒精性脂肪性肝病(NAFLD)的核心靶点的鉴定
从AS相关靶点和GM相关靶点的组合中获得的23个靶点数量与NAFLD相关靶点(1836个)进行了比较(附加文件1:表S1),最终确定了16个靶点作为预期能够在AS和GM应用中发挥组合疗效的真正靶点(图2D)。
PPI网络和MDA的关键目标
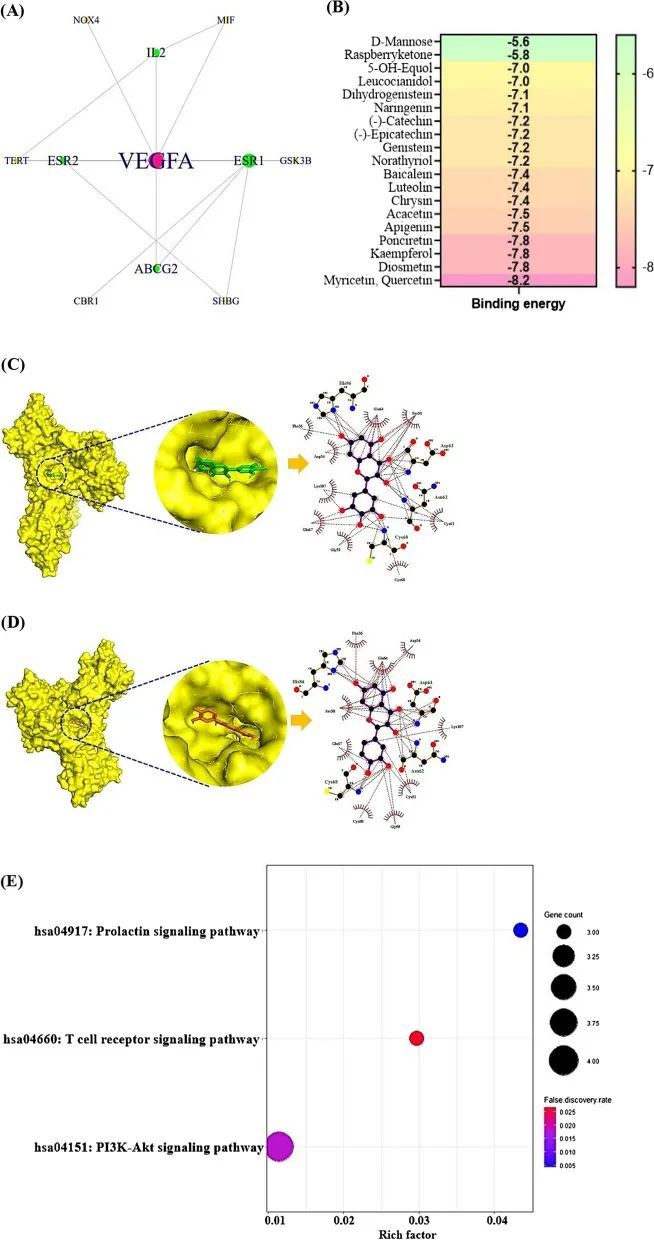
最终的16个靶点蛋白相互作用网络由11个节点和17条边组成,其中16个靶点中的5个(ALDH2、PON1、ERN1、NR4A1和GPR35)之间没有相互作用(图3A)。网络中的血管内皮生长因子A(VEGFA)具有最高的度值,其次是ESR1(7)、ESR2(3)、IL2(3)和TERT(3)(表3)。作者认为VEGFA是针对非酒精性脂肪肝的最重要的靶点。此外,MDA的结果显示,20个SMs中,槲皮素和槲皮素的结合能为-8.2 kcal/mol,是最低分数(图3B),这表明这些SMs(槲皮素和槲皮素)可以与VEGFA产生强大的结合亲和力(图3C、D)。GM能够将槲皮苷转化为槲皮素,适用的GM是大肠杆菌12、大肠杆菌33和肠球菌45 [45]。此外,Bacteroides sp. 45 [46]能将槲皮苷转化为槲皮素,Bifidobacterium dentium、Bacteroides uniformis和Bacteroides ovatus [47, 48]能将芦丁转化为槲皮素,Bacillus sp. 46 [49]能将山梨苷转化为槲皮素,Enterococcus sp. 45和大肠杆菌33 [45]能将槲皮苷转化为槲皮素,Enterococcus casseliflavus [50]能将异槲皮苷转化为槲皮素。这意味着GM对产生有利的后生物素有益,与此同时,槲皮素和槲皮素是能够稳定结合在VEGFA上的良好效应物。
气泡图和GASTM网络
PPI提供的气泡图显示了三条信号通路:催乳素信号通路、T细胞受体信号通路和PI3K-Akt信号通路(图3E)。在这三条信号通路中,直接与VEGFA相关的PI3K-Akt信号通路被认为是一个关键的信号通路(表4)。与PI3K-Akt信号通路相关的VEGFA、IL2、GSK3B和NR4A1被认为是有希望的显著靶点。值得注意的是,PI3K-Akt信号通路具有最低的富集因子,这表明该信号通路可能以拮抗模式发挥作用。这意味着较低的富集因子可以定义为注释信号通路中表达基因较少的数量[51]。
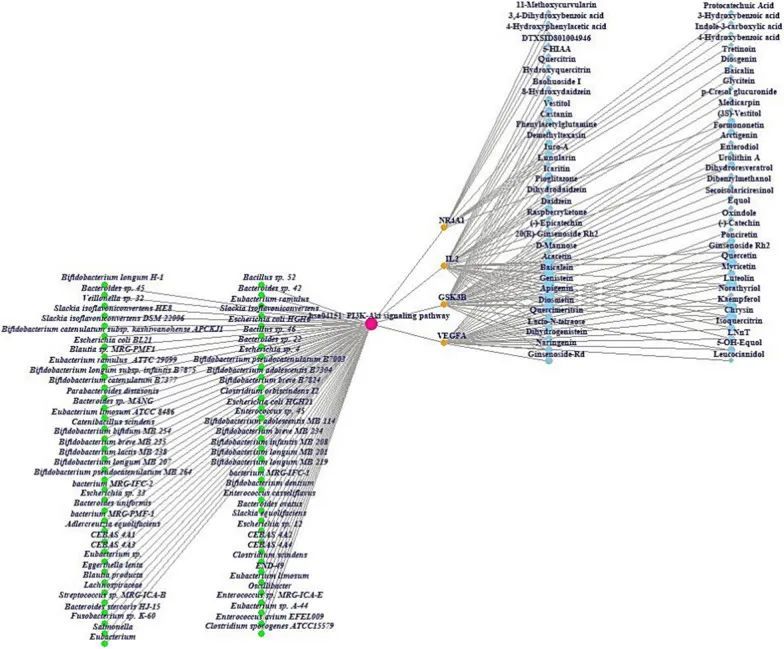
GASTM网络显示了GM(60个节点,绿色圆圈)或AS(1个节点,绿色圆圈)、PI3K-Akt信号通路(1个节点,绿色圆圈)、靶点(4个节点,橙色圆圈)和代谢物(56个节点,蓝天圆圈)之间的关系,共有122个节点和155条边(图4)。从整体的角度来看,这四个组成部分可以共同发挥治疗作用,并相互协调对抗非酒精性脂肪肝。
分子对接试验
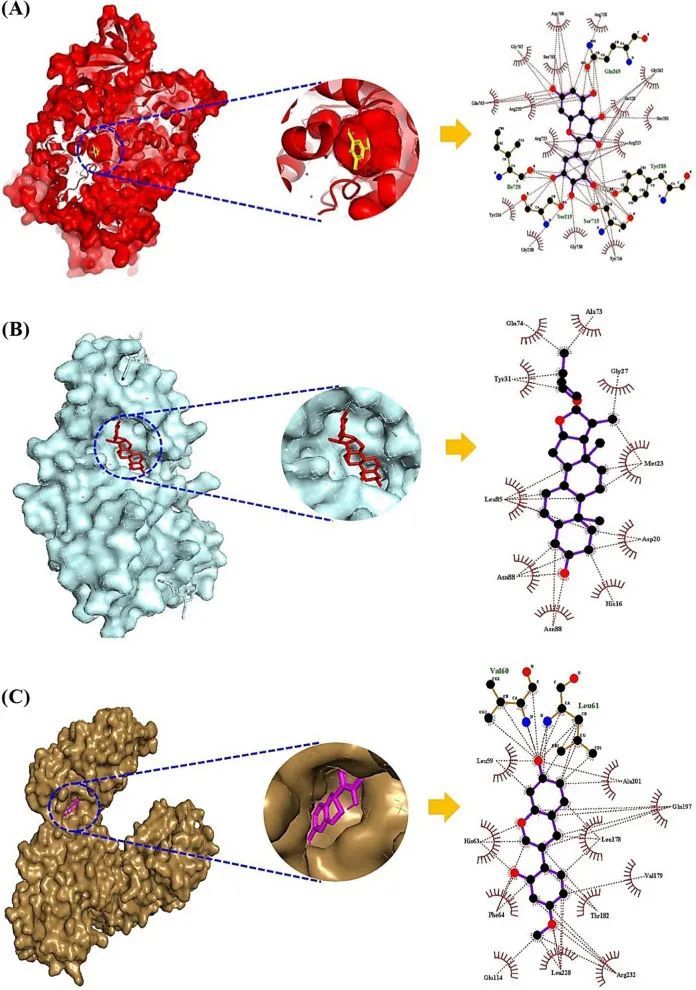
分子对接实验(MDA)显示了PI3K-Akt信号通路上有哪些有前景的SM(s),关键的SM(s)要么来自GM,要么来自AS。如前所述,VEGFA的关键SM(myricetin和quercetin)来自GM(Escherichia sp. 12,Escherichia sp. 33,Enterococcus sp. 45,Bacteroides sp. 45,Bifidobacterium dentium,Bacteroides uniformis,Bacteroides ovatus,Bacillus sp. 46和Enterococcus casseliflavus)。同样,GSK3B上的myricetin与-10.6 kcal/mol(图5A)具有最高的亲和力,来源于Escherichia sp. 12,Escherichia sp. 33和Enterococcus sp. 45。Diosgenin与IL2结合最稳定,亲和力最大,为-9.1 kcal/mol(图5B),可以从SCHEMBL20481776(PubChem ID:135312912)转化而来[52]。然而,GM能否转化diosgenin尚未揭示。NR4A1上的vestitol与-9.0 kcal/mol(图5C)形成了最稳定的构象,vestitol来自AS。MDA的信息在附加文件2:表S2中进行了概述。通过多种化合物和多个靶点,AS和有益的GM的组合应用可以参与通过PI3K-Akt信号通路治疗NAFLD。
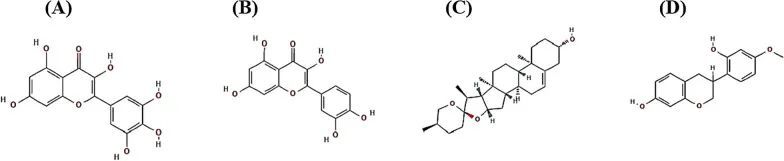
关键SM的药物相似性和毒性验证
四种SMs(myricetin,quercetin,diosgenin和vestitol)的数量符合Lipinski的规则,因此可能是开发治疗药物的重要因素。因此,毒性参数都得到了确认:hERG,人类肝毒性,致癌物,细胞毒性和眼腐蚀。因此,确定的四种SMs是针对NAFLD的有希望的候选药物(表5)。这四种SMs没有物理化学障碍成为治疗药物。关键SMs的化学结构如图6所示。
总结
总之,作者的研究通过联合应用肠道菌群(GM)和燕麦(AS)突出了治疗非酒精性脂肪肝(NAFLD)的疗效和机制,表明拮抗剂(槲皮素、槲脂素、脱氧豆甾醇和维斯托尔)通过抑制PI3K-Akt信号通路。这些发现为利用内源物种(肠道菌群)和外源物种(燕麦)进行基于微生物组的治疗提供了新的见解。然而,为了揭示真正的药理效果,这项研究应考虑体外或体内实验。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:veading@qq.com进行投诉反馈,一经查实,立即删除!