PSMC3蛋白酶体亚单位变体与神经发育迟缓和I型干扰素产生有关
今天给同学们分享一篇实验文章“PSMC3 proteasome subunit variants are associated with neurodevelopmental delay and type I interferon production”,这篇文章发表在Sci Transl Med期刊上,影响因子为17.1。

结果解读:
PSMC3变异的鉴定
第一个PSMC3变异体在患者#2中检测到,她是一个女性新生儿,出现严重的心脏、胃肠、炎症和免疫问题。全外显子测序(WES)突出了新生的非同义突变c.523A>G p.(M175V)(GenBank ID: NM_002804.4),在任何公共变异数据库(gnomAD,>246,000个染色体;NHLBI Exome Variant Server,>13,000个等位基因;Bravo,125,568个等位基因)中均不存在,并且通过生物信息学程序(包括SIFT、PolyPHen-2n CADD、REVEL和Metadome以及MobiDetails编译的所有程序)预测为致病性(40)。作者在材料和方法中描述的整体策略使作者能够在23个不相关的儿童中识别出15个不同的罕见的新生错义PSMC3变异体,这些儿童表现出神经发育迟缓(NDD)和各种先天性畸形。
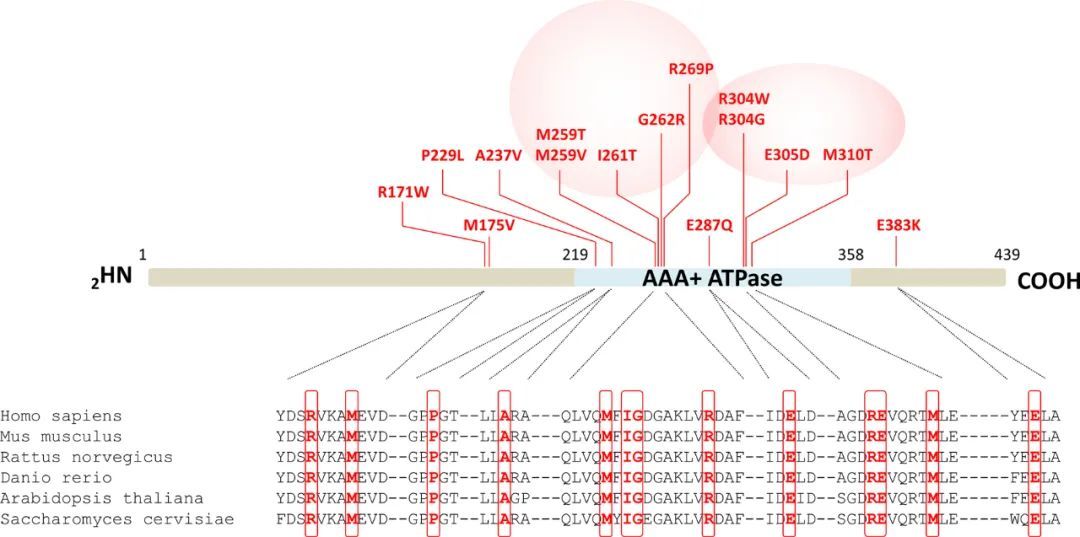
如图1所示,大部分PSMC3的替代位点位于AAA结构域中,该结构域被预测为不耐受变异。AAA结构域的两个不同区域特别容易发生替代。第一个热点位于重复变异c.910C>T p.(R304W)周围,该变异在四个无关的儿童中检测到,并包括变异c.910C>G p.(R304G)、c.915G>T p.(E305D)和c.929T>C p.(M310T)(图1)。第二个区域富含罕见变异[c.775A>G p.(M259V)、c.776T>C p.(M259T)、c.782T>C p.(I261T)(见六次)、c.784G>A p.(G262R)和c.806G>C p.(R269P)],位于N-末端位置(图1)。所有13个受影响的氨基酸残基在从哺乳动物到分裂酵母的物种中高度保守(图1)。携带PSMC3变异的所有个体的一个主要表型特征是神经发育或神经精神症状的优势。更详细地说,除了患者#2外,所有受影响的儿童都表现出发育迟缓(22/22;100%),其中包括仅有语言发育迟缓(19/19;100%)或伴有智力障碍(16/18;89%),以及运动发育迟缓(15/19;79%)。脑磁共振成像显示出频繁的异常(11/15; 73%),而异常行为(9/18; 50%)和癫痫发作(5/21; 24%)的发生率各不相同。19个人中有9个(47%)出现生长障碍,其中大多数有喂养困难(8/18; 44%)。骨骼畸形在骨骼中经常观察到[11/15; 73%; 脊柱侧弯,髋臼发育不良,短跖骨),心脏(10/18; 56%; 心室或室间隔缺损,动脉导管未闭,肺动脉高压和闭锁),肾脏(4/15; 27%; 马蹄形,盆腔积水,肾钙化和多囊性肾发育不良),以及头部(6/17(35%)的小头畸形;相对于2/16(13%)的严重巨头畸形)。19个人中有2个(11%)发现肿瘤(颅咽管瘤和神经母细胞瘤)。9/19个人(47%)检测到听力损失,并分别标记为感音神经性和传导性。大多数儿童(18/20; 90%)表现出畸形的面部特征(图)。S2),包括高额头或宽额头(7/19; 37%),上唇薄且口角向下(6/19; 32%),异常腭(5/19; 26%),内眦褶皱(5/19; 26%),以及口腔面裂(2/19; 10%)。通过GestaltMatcher(41)对面部形态进行的计算分析显示,携带PSMC3变异的患者的面部畸形相当多样化,只有携带相同变异的患者之间存在相似之处。
成年果蝇中PSMC3的Drosophila同源基因Rpt5的沉默未能逆转刺激条件
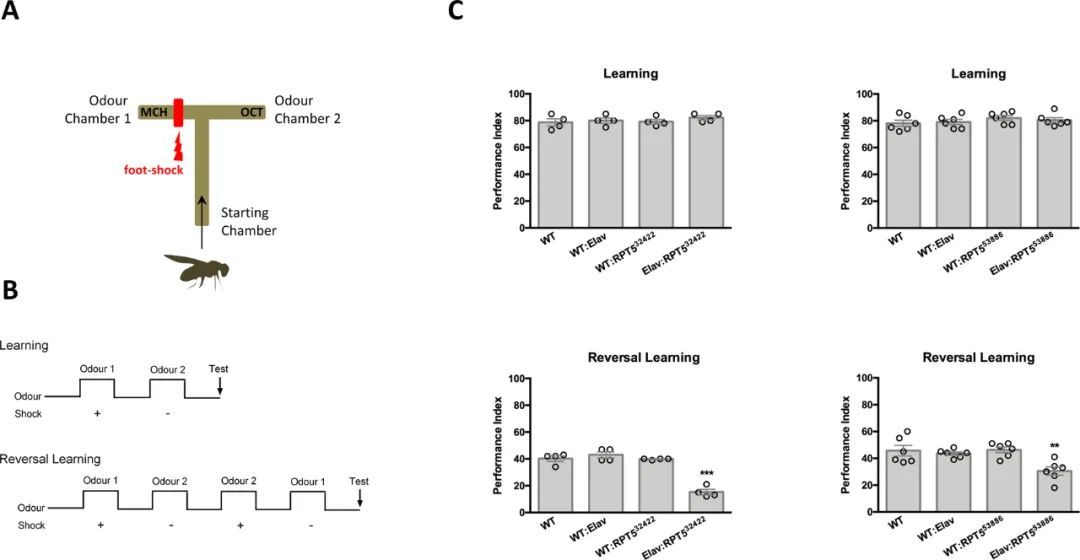
鉴于携带PSMC3变异体的患者表型的神经元性质,作者接下来试图通过评估果蝇Drosophila melanogaster的学习表现来探讨PSMC3在认知功能中的潜在参与,该果蝇通过两种不同的siRNA(即Rpt5 32422 和Rpt5 53886 )靶向Rpt5转录本的两个不同位点进行了Rpt5的RNAi敲低,Rpt5是人类PSMC3的同源物。为此,作者使用了标准的气味回避范式进行条件训练,动物暴露于两种不同的气味(3-辛醇,OCT或4-甲基环己醇,MCH),其中只有一种气味会同时施加电击(OCT + ,MCH ? ),如先前描述的(42)(图2A和B)。使用神经元特异性胚胎致死异常视觉系统(Elav)启动子下的Rpt5 RNAi沉默Rpt5,对于Rpt5 32422 (WT vs. Elav:RPT5 32422 ,P=0.6435,N=4)或Rpt5 53886 (WT vs. Elav:RPT5 53886 ,P=0.5282,N=6)siRNA,学习表现没有显著差异(图2C)。作者接下来通过训练初始气味-电击配对(OCT + ,MCH ? )后立即进行反向气味-电击配对的训练(OCT ? ,MCH + )来确定Rpt5沉默果蝇的逆转学习表现(图2B,下面的面板)。使用泛神经元Rpt5 RNAi表达的Rpt5 32422 (WT vs. Elav:RPT5 32422 ,P<0.0001,N=4)或Rpt5 53886 (WT vs. Elav:RPT5 53886 ,P=0.0022,N=6)siRNA,逆转学习表现明显较差。三个对照组再次没有显著差异(图2C)。这些数据表明,PSMC3同源物Rpt5似乎是果蝇学习关联变化的先决条件。
PSMC3/Rpt5的异位表达或其变体对神经发育产生不同影响
鉴于PSMC3/Rpt5基因沉默对逆转学习的负面影响,作者接下来想知道PSMC3是否参与了海马神经元树突发育的调控。因此,作者在小鼠原代海马神经元中异位表达野生型PSMC3/Rpt5,然后进行神经突起长度的定量测量,如之前所述(43)。体外早期发育时间点(DIV3)表达野生型PSMC3/Rpt5导致神经元的突起长度显著减少(空载体对比PSMC3 WT,p=0.0089)。这些结果表明,异位表达野生型PSMC3/Rpt5可能对神经突起生长有害。接下来,作者想确定在NDD/ID患者中发现的不同PSMC3/Rpt5变体在神经元中异位表达时是否与野生型PSMC3/Rpt5表现不同。R304W、E305D和E383L PSMC3/Rpt5变体的表达导致与野生型PSMC3/Rpt5相似的神经形态学变化。相比之下,与空载体对照相比,M175V变异体的表达对神经元形态没有影响,并且与野生型PSMC3/Rpt5相比显示出显著改善。M175V PSMC3/Rpt5变异体对神经突起长度和分枝的积极影响令人着迷,但并不反映突变亚单位与19S帽子蛋白酶体复合物的结合能力增强。此外,这些观察结果并不排除该变异体的病理性较轻,因为所见的形态学变化对神经突起的生长不一定有益。综上所述,这些结果表明PSMC3/Rpt5参与调节神经突起发育,而对该基因的任何改变可能会对这一过程产生积极或消极的影响。
PSMC3基因变异对PSMC3/Rpt5稳态蛋白表达产生不同影响
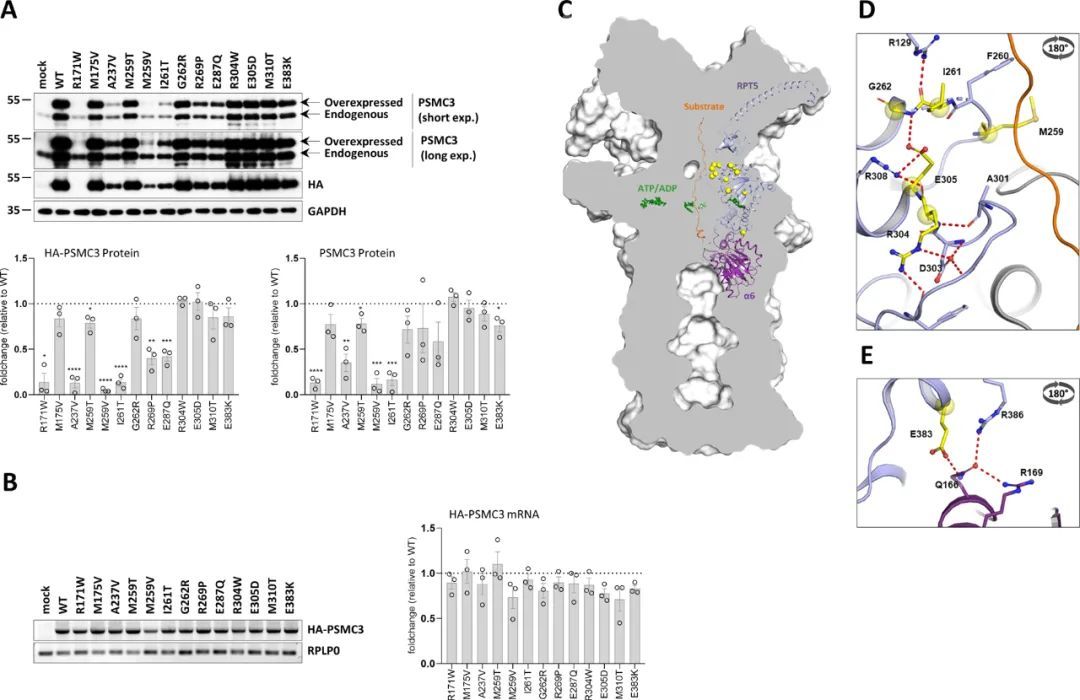
由于错义变异可能通过影响mRNA和/或蛋白质的稳定性导致单倍体不足,因此作者接下来试图确定已鉴定的PSMC3变异对PSMC3/Rpt5稳态蛋白表达的影响。为此,作者在SHSY5Y神经母细胞瘤细胞系中表达了13个PSMC3变异体,这些变异体在Western-blot分析之前与一个融合的N-末端血凝素(HA)串联重复序列结合。如图3A所示,携带R171W、A237V、M259V和I261T突变的四个PSMC3/Rpt5变异体的PSMC3/Rpt5蛋白表达较其野生型对应物较低。对这些构建物中HA-PSMC3带(图3A,左下方)和PSMC3带(图3A,右下方)的密度分析显示,与野生型HA-PSMC3相比,PSMC3/Rpt5蛋白表达降低了约90%(图3A)。然而,在SHSY5Y细胞中,所有PSMC3变异体在24小时质粒驱动表达下产生了相等数量的HA-PSMC3转录本,通过RT-PCR和密度计量确定(图3B),因此表明降低的蛋白表达是由于增加的蛋白质降解、降低的翻译效率或两者共同导致的。为了确定这些效应是否也可能由非致病性的PSMC3突变引起,作者接下来分析了基因组聚合数据库(gnomAD)中报道的三个带有HA标签的单核苷酸多态性(SNP)PSMC3/Rpt5变体(I77N,I291V和P355L)的稳态表达。这三个研究的SNP表现出与其野生型对应物类似的行为,这表明PSMC3/Rpt5蛋白表达的降低可能是某些致病变异的特定特征。
结构建模预测PSMC3的替代会影响蛋白酶体亚基之间的内部和互分子相互作用
作者接下来尝试预测每个PSMC3的十四个突变对结构的影响,通过评估由Dong等人生成的人类26S蛋白酶体结构中突变残基的定位(蛋白质数据银行,PDB入口代码:6MSK)(45)。大多数受影响的氨基酸出现在PSMC3/Rpt5的N-末端α/β结构域中,其中五个残基(G262、I261、M259、R304和E305)位于两个相邻于底物通道的环上,指向AAA-ATP酶环的中心(图3C和D)。具体来说,在一个环上,G262通过主链氢键与E305固定,从而促进了包含M259的前一个环的灵活性。此外,E305本身通过与其前一个残基R304形成的盐桥与R308保持连接,稳定了相邻环的极性网络。由于这六个残基稳定或是环的三级结构的一部分,对这些氨基酸的任何改变都预计会影响底物的转运以及与其他AAA-ATP酶亚单位的相互作用。A237V变体在结构上一开始很难分类并且不容易被察觉。然而,不能排除在位置237处残基大小的轻微增加可能导致结构变化。在SHSY5Y细胞中的过表达实验表明,这种替代确实影响侧链的排列和蛋白质的稳定性(图3A)。E383L错义变体是PSMC3/Rpt5的C端α-螺旋结构域中唯一的替代物,紧邻19S-20S界面。E383与PSMA1/α6亚单位的Q166通过与R169和R386残基的极性相互作用保持联系(图3E)。因此,将带负电的E383替换为带正电的K383预计会破坏这种氢键网络,并影响19S复合物与20S核心粒子的结合。E287也位于ATP结合位点附近,将其替换为Q287可能会产生与N333的额外极性键,可能会影响ATP的结合、水解或两者都受到影响。R171位于PSMC3/Rpt5-PSMC2/Rpt1界面,并且是与相邻的D169和Q258残基相关的极性网络的一部分。因此,预测在这个位置将带正电的精氨酸替换为疏水的色氨酸会破坏这些相互作用,进而影响两个亚单位之间的接触。将M175改变为V175导致了一个极化的巯基和亲水环境的丧失,这可能会不稳定蛋白质区域的三级结构。综上所述,这些数据表明,复合物26S蛋白酶体结构可能会受到已鉴定的PSMC3错义变异的强烈影响,尽管不能完全排除无功能的PSMC3/Rpt5亚单位对蛋白酶体结构没有不利影响的可能性。
PSMC3变体对蛋白酶体组装产生不同影响
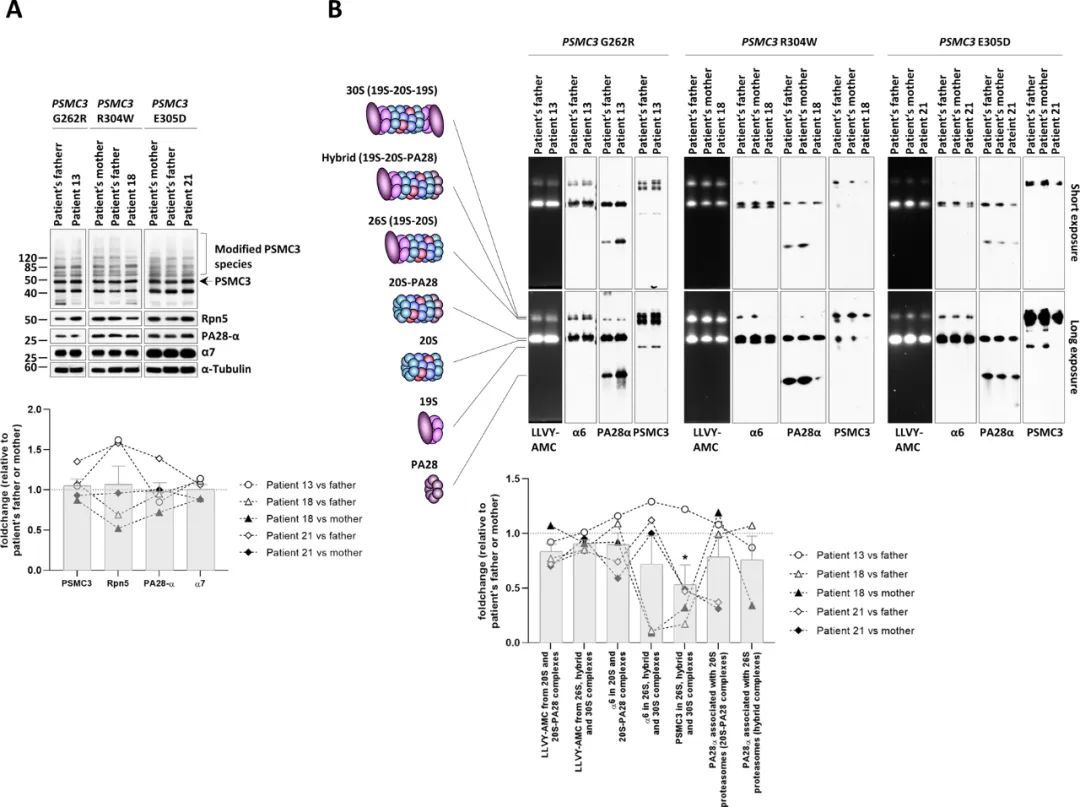
为了进一步研究PSMC3变异体的致病性,分析了13号、18号和21号患者的T细胞的蛋白酶体含量。α7蛋白酶体亚单位和PA28-α的细胞内表达在相对对照组(父亲、母亲或两者)和指标病例之间没有变化(图4A)。同样,突变T细胞中19S亚单位PSMD12/Rpn5的丰度与其对照组相当。从对照组和患者中扩增的T细胞显示出两个突出的PSMC3/Rpt5免疫反应带,迁移速度约为50和40 kDa(图4A)。尽管迁移速度约为50 kDa的上带对应于PSMC3/Rpt5的预期大小,但迁移速度约为40 kDa的下带的性质尚不清楚。然而,这个带可能不是非特异性的,因为它可以用另一种抗-PSMC3/Rpt5抗体在T细胞中检测到,或者在其他细胞类型中检测到。这种额外的物种可能反映了一种较短的、尚未描述的PSMC3/Rpt5亚型,或者是由PSMC3/Rpt5全长蛋白产生的加工形式。然而,控制组和患者之间PSMC3/Rpt5的蛋白质表达谱没有发生变化,这表明这些现象都不受任何PSMC3变体的影响。同样,PSMC3变体T细胞中也没有显示出PSMC3/Rpt5全长蛋白的表达减少,这表明这些受影响个体中的蛋白酶体功能障碍不是由于半失活引起的。
定量蛋白质组学鉴定了PSMC3功能缺失对NDD/ID患者影响的细胞通路
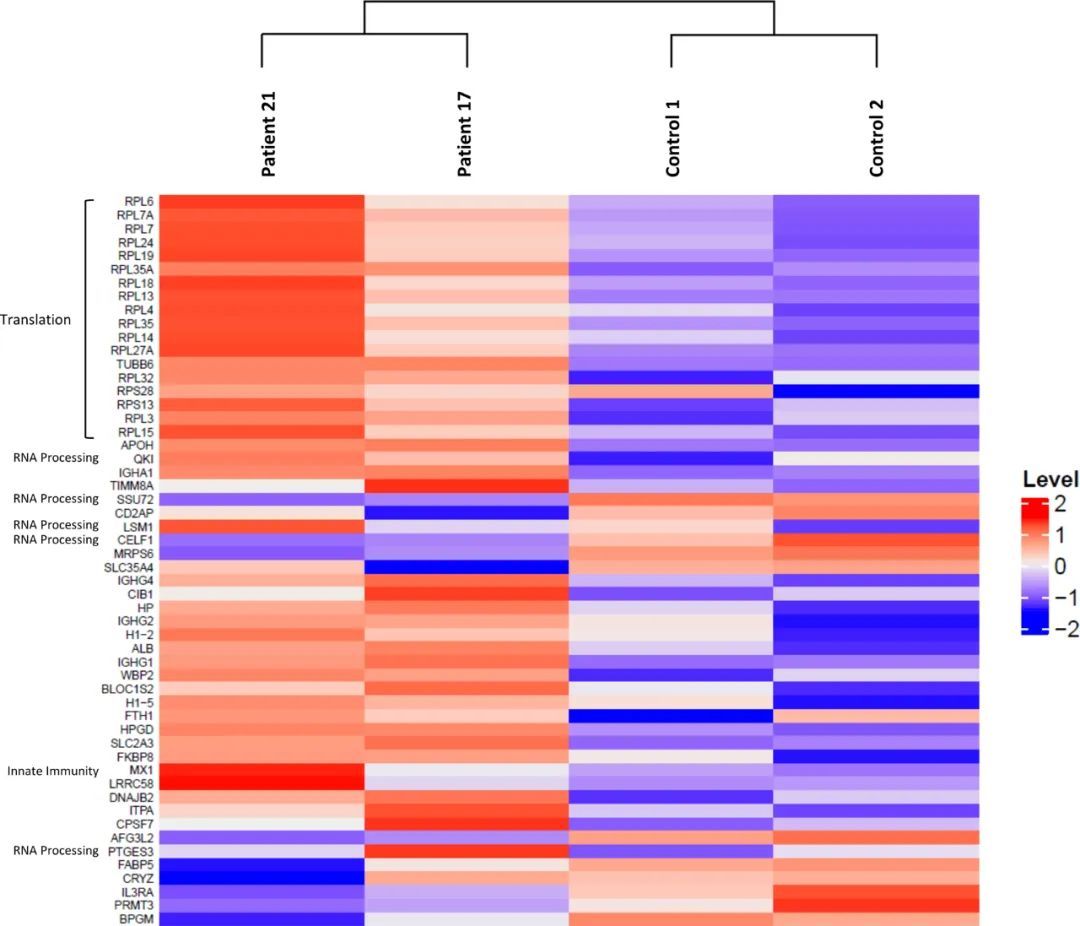
为了更好地了解PSMC3功能丧失对细胞的影响,作者接下来通过基于质谱的比较分析,比较了患者#17和患者#21(分别为R304W和E305D)的T细胞蛋白组与其相对对照组之间的差异。如图5所示,作者的数据发现了一个蛋白质特征,其中包括了17个小40S核糖体亚基(RPS)或大60S核糖体亚基(RPL)的核糖体蛋白,这些蛋白在两个研究对象中都有特异性上调。这表明mRNA翻译是PSMC3功能丧失后的一个主要受影响的通路,这一观点进一步得到了支持,因为mRNA处理机制的组分,如CUG结合蛋白Elav-Like家族成员1(CELF1),RNA结合蛋白LSm家族成员1(LSM1),RNA聚合酶II CTD磷酸酶(SSU72)和肌苷酸三磷酸酶(ITPA),在患者和对照组之间也有差异表达(图5)。其他显著蛋白质的丰度在携带PSMC3变异的患者中有所变化,包括免疫系统的成分,如MX类似动力蛋白1(MX1)-典型的干扰素刺激基因产物-和IL3受体的α链(IL3RA)。这些蛋白质的调节方向相反,两个患者都表现出更高的MX1含量,但IL3RA含量减少(图5)。作者的分析进一步揭示,PSMC3功能丧失还与H1.5和H1.2连接组蛋白H1变体的蛋白质表达增加相关,这与UPS在染色质调控中的作用一致(46)。蛋白质集富集分析揭示,控制组和携带PSMC3变异的患者之间最显著(P<0.05)的蛋白质变化与mRNA代谢和翻译有关,证实了这些患者的蛋白质合成失调。在携带PSMC3变异的T细胞中富集的其他差异表达蛋白质属于病毒过程类别,揭示了蛋白酶体功能丧失与先天免疫之间的潜在关系。综合来看,这些数据表明携带PSMC3变异的患者在基本细胞过程中出现了改变,包括mRNA翻译、免疫信号传导和染色质重塑。
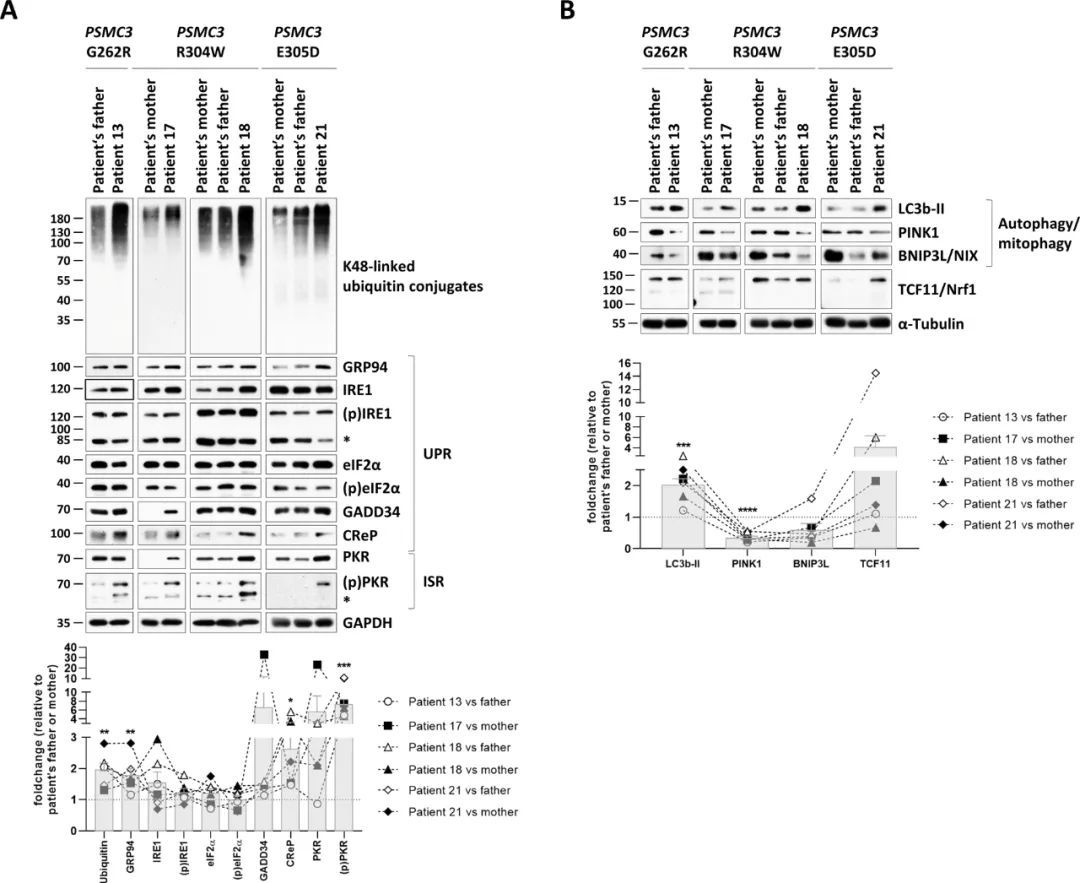
PSMC3变异导致患者T细胞中的蛋白质毒性应激
蛋白酶体功能障碍已被证明伴随着泛素-蛋白质共轭物和蛋白质毒性应激的积累(24)。如图6A所示,通过免疫印迹和密度分析,所有四个研究对象表现出不平衡的蛋白质稳态特征,即与其相应的对照组相比,泛素修饰物的积累增加。已知蛋白质毒性应激会诱导未折叠蛋白应答和整合应激应答(UPR和ISR,分别)(24, 47)。为了解决这一问题,作者量化了葡萄糖调节蛋白94伴侣蛋白(GRP94,内质网中的热休克蛋白90kDa)的表达,其上调被认为是UPR的主要标志(48)。所有患者的GRP94表达增加(图6A)。然而,UPR的激活仅部分发生,因为IRE1和eIF2α两个其他UPR标志物的磷酸化和激活状态在携带PSMC3变异体的患者和对照组之间没有改变(图中未显示)。6A)。尽管上游激酶PKR在所有患者中一直被激活(图6A),但未能检测到磷酸化的eIF2α增加,可以通过在所有四个患者中上调eIF2α磷酸酶GADD34(生长抑制和DNA损伤诱导蛋白34)和CReP(eIF2α磷酸化的构成性抑制剂)来解释。免疫印迹和密度分析显示,携带PSMC3变异体的患者的T细胞也具有增加的微管相关蛋白1A/1B-轻链3磷酸酶乙醇胺共轭物LC3b-II的蛋白表达(图6B),这表明这些细胞无法通过它们的26S蛋白酶体清除泛素-蛋白聚集体细胞,从而触发了通过激活自噬系统的代偿机制。一致地,携带PSMC3变异体的患者中线粒体蛋白PINK1(PTEN诱导的假定激酶蛋白1)和Bnip3L/NIX(BCL2/腺病毒E1B 19 kDa蛋白相互作用蛋白3样/NIP3样蛋白X)被发现减少(图 6B),支持选择性自噬过程(包括线粒体自噬)在PSMC3破坏后被激活的观点。由于蛋白酶体功能障碍通常导致TCF11/Nrf1(转录因子11/核因子,红细胞衍生2,类似1)蛋白从内质网膜释放(49, 50),作者接下来试图确定NDD/ID患者中TCF11/Nrf1的处理模式。然而,作者未能在携带PSMC3变异的患者和对照组之间检测到TCF11/Nrf1处理模式的差异(图6B),这表明与NDD/ID相关的PSMC3变异不会导致TCF11/Nrf1信号通路的激活。
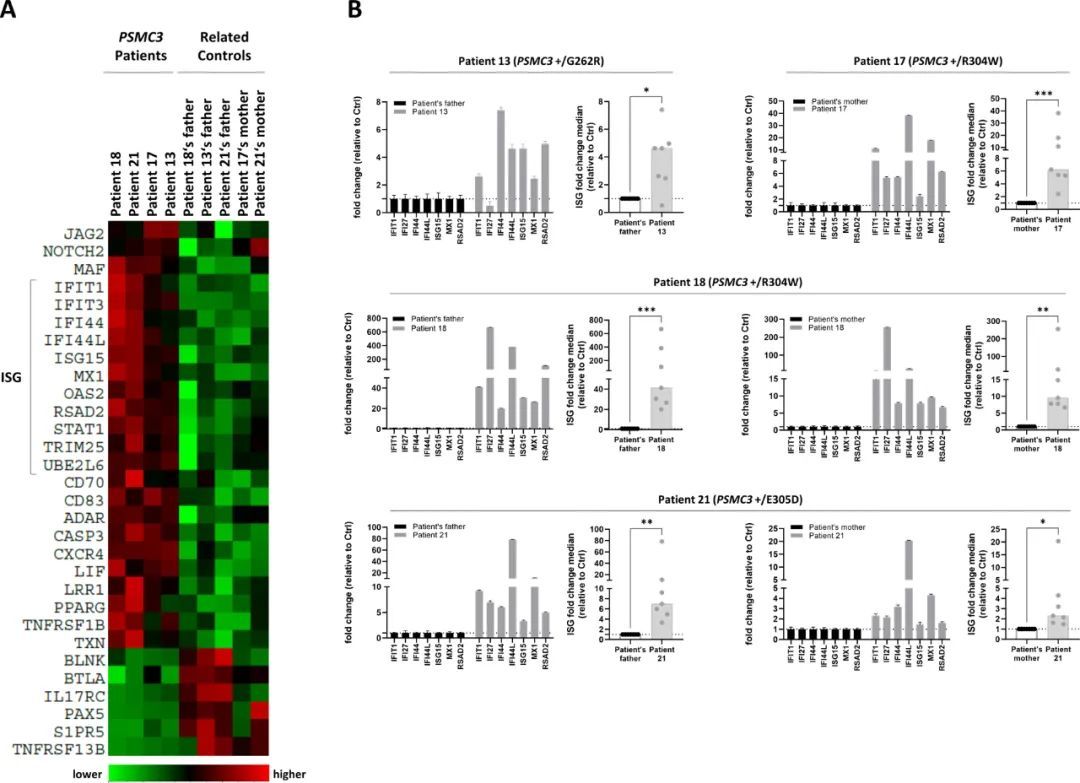
具有PSMC3变体的T细胞表现出I型IFN特征
由于蛋白酶体功能丧失导致PRAS患者产生典型的I型IFN应答(30),作者接下来试图确定PSMC3基因的改变是否也会诱导I型IFN-信号。为此,作者使用NanoString?nCounter平台对携带PSMC3变体的患者和相关对照(父亲和/或母亲)的T细胞中750个预先定义的免疫相关基因的mRNA表达进行了比较检查。总共可以鉴定出30个差异表达的基因,包括11个IFN刺激的基因(ISG),这些基因在所有携带PSMC3变体的患者中特异性上调(图7A),表明PSMC3功能丧失与I型IFN反应有关。对照和患者T细胞的转录组学分析进一步显示,PSMC3破坏导致notch信号通路的基因上调,如NOTCH2(神经源性基因座notch同源蛋白2)和JAG2(蛋白jagged-2),它们参与包括神经发育在内的发育通路(51)(图7A)。为了验证作者的组学分析揭示的I型IFN基因特征,作者接下来评估了七种ISG(IFI27、IFI44L、IFIT1、ISG15、MX1、RSAD2和IFI44)在这四个具有PSMC3错义变体的家族的样本中的表达。如图7B所示,所有四个受影响儿童的样本(患者#13、#17、#18和#21)都表现出比他们的父母(父亲和/或母亲)高得多的ISG表达。七个ISG的倍数变化中位数的计算显示,与各自的对照组相比,所有PSMC3指数病例均显著增加(患者13与父亲,p=0.0148;患者17与母亲,p=0.008;患者18与父亲,p=0.0002,患者18与母亲,p=0.0011;患者21与父亲,p=0.0012,患者21与母亲,p=0.0142)(图7B)。在患者#18中观察到最强的I型IFN特征,与父亲或母亲相比,其ISG分别上调约40或10倍。患者#13、#17和#21表现出较温和的I型IFN诱导,其特征在于ISG转录物比其各自的对照增加2-6倍。在测试的七个ISG中,IFIT1和IFI44L是在所有四个受影响个体中经历最显著上调的基因。
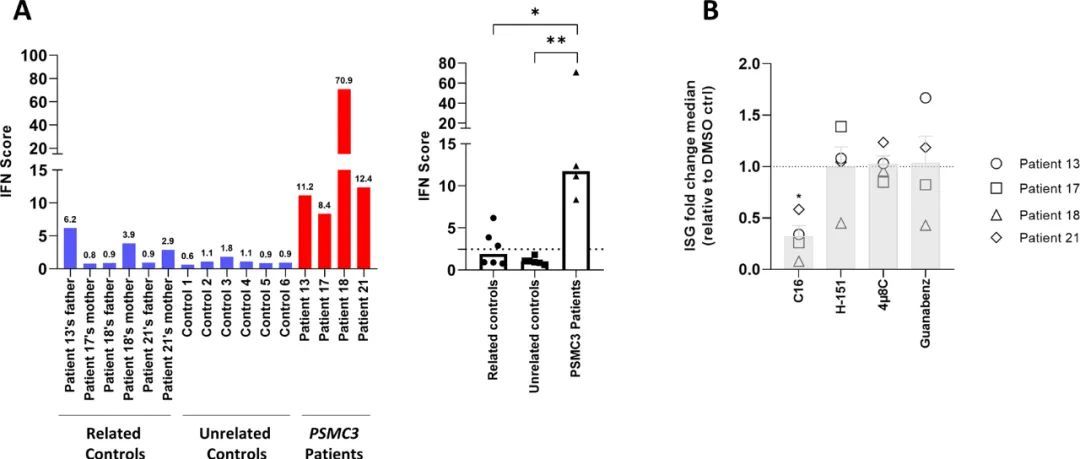
PSMC3突变T细胞中产生的I型IFN信号是PKR依赖性的
接下来,作者计算并比较了携带PSMC3变体的两名患者及其相关对照与从六名健康供体中分离的T细胞的IFN评分。如图8A所示,三个相关对照的IFN评分略高于Rice等人定义的2.466的临界值,属于异常(52)。然而,所有相关和非相关对照的IFN评分仍显著低于四名受试患者的IFN得分(P=0.0845和P=0.00044),从而证实这些PSMC3变体与I型IFN信号增强有关。在入组后14个月对18号患者进行的第二次独立评估显示,该患者仍然表现出非常高的I型IFN评分。由于所有三个诱导型免疫蛋白酶体亚基β1i(PSMB9)、β2i(PSMB 10)和β5i(PSM B8)都由通常由I型和II型IFN刺激的基因编码(20),作者接下来询问PSMC3功能的丧失是否伴随着从标准蛋白酶体到免疫蛋白酶体的转变。通过蛋白质印迹测定,这些亚基在T细胞中的稳态表达在对照组和患者之间没有显著变化。这可能是由于已知的事实,即T细胞作为免疫细胞,表达大量的免疫蛋白酶体,这一特征使得诱导亚基的任何进一步的蛋白质上调都非常困难(53)。
总结
在这项研究中,作者在23个NDD/ID无关个体中鉴定了PSMC3基因的15个错义变体,并表明19S AAA ATP酶蛋白酶体亚基PSMC3/Rpt5是中枢神经系统(CNS)发育的关键蛋白。这一观点与先前的报告一致,先前的报告显示,小鼠中其他19S蛋白酶体亚基(Psmc2/Rpt2和Psmc4/Rpt3)的条件失活导致具有神经退行性变和运动功能障碍特征的严重神经元表型。最近,在PSMC3基因中产生一个神秘外显子的纯合深内含子变体与家族隐性神经感觉综合征有关。对这篇文章的思路感兴趣的老师,欢迎咨询!
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:veading@qq.com进行投诉反馈,一经查实,立即删除!